الطفرات الجينية: كيف تحدث وما أنواعها؟
ما الفرق بين الطفرة الوراثية والمكتسبة وهل جميع الطفرات ضارة؟

الطفرات الجينية هي تغيرات دائمة تطرأ على تسلسل النيوكليوتيدات في جزيء الحمض النووي الريبوزي منقوص الأكسجين (DNA). تنشأ هذه التغيرات تلقائياً أثناء انقسام الخلايا أو بفعل عوامل خارجية كالإشعاع والمواد الكيميائية. وقد تكون مفيدة أو ضارة أو محايدة، وتلعب دوراً محورياً في التنوع البيولوجي والأمراض الوراثية والطب الحديث.
هل تساءلت يوماً لماذا يُصاب شخص بمرض وراثي لم يُصب به أحد من عائلته قبله؟ أو لماذا يُولد طفل بصفة جسدية لا تشبه أياً من والديه؟ أنت أمام لغز بيولوجي اسمه الطفرات الجينية. لقد شغلت هذه الظاهرة العلماء لعقود طويلة، ولا تزال تكشف لنا أسراراً جديدة كل عام. في هذا المقال ستجد كل ما تحتاج معرفته عن أنواعها وآلياتها وتأثيراتها على صحتك وصحة أسرتك، بلغة واضحة تجمع بين الدقة العلمية والتبسيط الذي يناسبك سواء كنت طالباً أو مهتماً بالعلوم أو أباً يبحث عن إجابات.
📌 خلاصة المقال في دقيقة واحدة
🔬 حقائق جوهرية
- الطفرة الجينية تغيّر دائم في تسلسل الـ DNA — قد يكون بحرف واحد أو بكروموسوم كامل.
- ثلثا الطفرات السرطانية تنتج عن أخطاء عشوائية أثناء انقسام الخلايا وليس عن عوامل بيئية.
- جسمك يُصلح نحو 10,000 تلف في الـ DNA يومياً عبر أربع آليات إصلاح متخصصة.
- كل إنسان يحمل 100-200 طفرة جديدة لم يرثها من والديه — معظمها محايد.
✅ خطوات عملية تحميك وتحمي أسرتك
- أجرِ فحص ما قبل الزواج الجيني — خاصة للكشف عن فقر الدم المنجلي والثلاسيميا.
- قلّل التعرض للمطفرات: تجنب التدخين، احمِ جلدك من الشمس، تجنب الأغذية الملوثة بالأفلاتوكسين.
- استشر طبيب وراثة إذا ظهر مرض وراثي في عائلتك — التشخيص المبكر يُغيّر المسار.
🚀 ما الجديد في عالم الطفرات؟
- وافقت الـ FDA عام 2023 على أول علاج جيني بتقنية CRISPR لفقر الدم المنجلي والثلاسيميا (Casgevy).
- أدوات جديدة مثل Prime Editing تُعدّل حرفاً واحداً في الـ DNA دون قص الشريط — دقة غير مسبوقة.
- مشروع الجينوم السعودي يرسم خريطة وراثية شاملة للسكان لتحديد الطفرات الأكثر انتشاراً محلياً.
⚠️ تحذير مهم
- ليست كل الطفرات ضارة — الغالبية محايدة، وبعضها مفيد كمقاومة الملاريا وتحمل اللاكتوز.
- فشل أنظمة إصلاح الـ DNA يرفع خطر السرطان بمعدل يصل إلى 1000 ضعف في بعض الحالات.
ما وراء الشفرة الوراثية: لماذا نهتم بدراسة الطفرات؟
لولا الطفرات الجينية لما وُجد هذا التنوع الهائل في الكائنات الحية على كوكبنا. لكن وجهها الآخر قد يكون مدمراً. هذه الحقيقة وحدها كافية لتجعل دراسة الطفرات ضرورة علمية لا ترفاً أكاديمياً.
إن الطفرة في أبسط تعريفاتها هي تغيّر دائم يصيب تسلسل القواعد النيتروجينية (Nitrogenous Bases) داخل جزيء الـ DNA. هذا التغيّر قد يكون صغيراً جداً — كاستبدال حرف واحد في شفرة يبلغ طولها ثلاثة مليارات حرف — أو ضخماً يشمل فقدان أجزاء كاملة من كروموسوم (Chromosome). فالأمر أشبه بكتاب ضخم حدث فيه خطأ مطبعي: أحياناً يمر دون أن يلاحظه أحد، وأحياناً يقلب معنى الجملة رأساً على عقب.
فلماذا ندرس الطفرات تحديداً؟ الإجابة تتشعب في اتجاهات عدة. أولاً، لأنها المسؤولة عن آلاف الأمراض الوراثية التي تصيب ملايين البشر. ثانياً، لأن فهمها يساعد الأطباء في تشخيص السرطانات وعلاجها. ثالثاً، لأنها أصبحت أداة في الطب الجنائي (Forensic Medicine) لتحديد هوية الأشخاص. بل إن كثيراً من برامج الفحص الجيني قبل الزواج في المملكة العربية السعودية تعتمد أساساً على الكشف عن طفرات معينة مرتبطة بأمراض كفقر الدم المنجلي (Sickle Cell Anemia) والثلاسيميا (Thalassemia)؛ إذ تُشير إحصائيات برنامج الفحص قبل الزواج السعودي إلى أن نسبة حاملي سمة الخلايا المنجلية في بعض مناطق المملكة تتجاوز 20%.
اقرأ أيضاً: علم الوراثة (Genetics): المبادئ الأساسية وتطبيقاتها
💡 معلومة مهمة
جسمك يحتوي على نحو 37 تريليون خلية، وكل خلية تحمل نسخة كاملة من حمضك النووي. هذا يعني أن أي خطأ أثناء نسخ هذا الحمض قد يتكرر ملايين المرات إذا لم يُكتشف مبكراً.
اقرأ أيضاً: الخلية (Cell): الوحدة الأساسية للحياة
كيف تحدث الطفرة على المستوى الجزيئي؟
لفهم أسباب حدوث الطفرات يجب أولاً أن نفهم كيف يُنسخ الحمض النووي. عندما تستعد الخلية للانقسام، ينفصل شريطا الـ DNA عن بعضهما، ويبدأ إنزيم بوليميراز الحمض النووي (DNA Polymerase) بصنع نسخة جديدة من كل شريط. هذه العملية مذهلة في دقتها؛ إذ يُنسخ نحو ثلاثة مليارات قاعدة نيتروجينية بمعدل خطأ لا يتجاوز واحداً في كل مليار قاعدة بعد التصحيح. لكن حتى هذه الدقة الخارقة ليست مطلقة.
تخيّل أنك تنسخ كتاباً مؤلفاً من ثلاثة مليارات حرف يدوياً. مهما بلغت دقتك، فستقع في أخطاء مطبعية هنا وهناك. هذا بالضبط ما يحدث داخل خلاياك. فقد تضيف الآلة الجزيئية قاعدة خاطئة، أو تتخطى قاعدة، أو تُكرر جزءاً لم يكن مطلوباً.
ما هي المطفرات وكيف تختلف عن الأخطاء الطبيعية؟
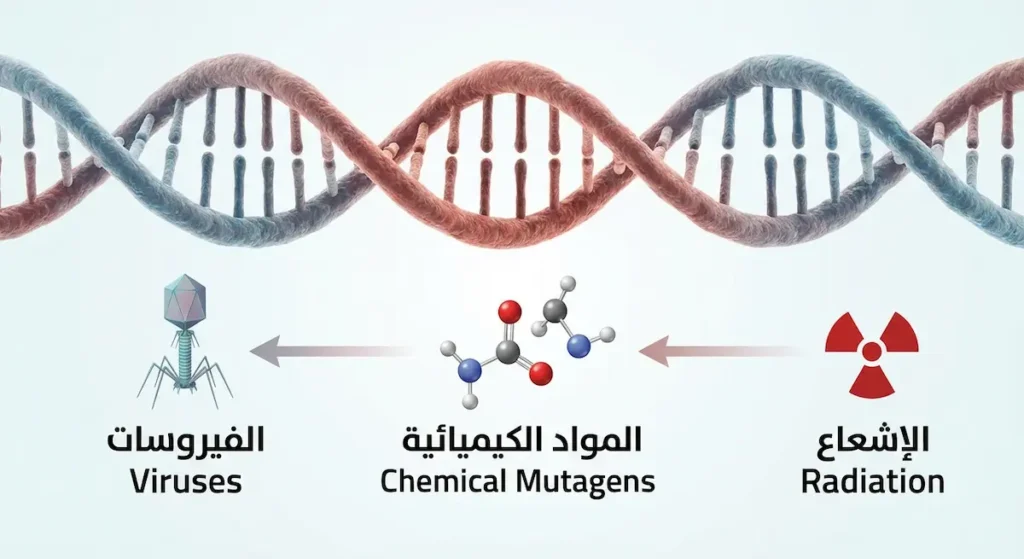
لا تقتصر أسباب حدوث الطفرات على الأخطاء العفوية أثناء النسخ. هناك عوامل خارجية وداخلية تزيد من احتمال حدوثها بشكل ملحوظ. هذه العوامل تُسمى المطفرات (Mutagens)، وتنقسم إلى فئات واضحة:
المطفرات الخارجية:
- الإشعاع (Radiation): يشمل الأشعة فوق البنفسجية (UV) من الشمس، والأشعة السينية (X-rays)، والإشعاع النووي. الأشعة فوق البنفسجية مثلاً تُسبب ارتباطاً غير طبيعي بين قواعد الثايمين المتجاورة (Thymine Dimers)، مما يُعطل عملية النسخ.
- المواد الكيميائية: مثل البنزوبيرين (Benzopyrene) الموجود في دخان السجائر، والأفلاتوكسين (Aflatoxin) الذي تنتجه فطريات تلوث المكسرات والحبوب المخزنة بشكل سيئ.
- الفيروسات: بعض الفيروسات تُدخل مادتها الوراثية في حمض الخلية النووي، مما يُسبب اضطراباً في الجينات المجاورة. فيروس الورم الحليمي البشري (HPV) مثال بارز.
المطفرات الداخلية:
- أخطاء إنزيم DNA Polymerase أثناء التضاعف.
- تلف تلقائي للقواعد النيتروجينية بفعل عمليات الأيض الطبيعية.
- الجذور الحرة (Free Radicals) التي تنتج من التنفس الخلوي.
أثبتت دراسة منشورة في مجلة Science عام 2017 (Tomasetti & Vogelstein) أن نحو ثلثي الطفرات في الأنسجة البشرية تنتج عن أخطاء عشوائية أثناء تضاعف الـ DNA، بينما يُسهم العامل البيئي والوراثي في الثلث المتبقي. هذا الاكتشاف غيّر فهمنا لأسباب السرطان بشكل جذري.
| نوع المطفر | أمثلة | مصدر التعرض | آلية التأثير على الـ DNA |
|---|---|---|---|
| الإشعاع (Radiation) | الأشعة فوق البنفسجية (UV)، الأشعة السينية (X-rays)، أشعة غاما (Gamma Rays) | أشعة الشمس، التصوير الطبي، الحوادث النووية | تكوين ثنائيات الثايمين (Thymine Dimers) وكسر شريط الـ DNA |
| المواد الكيميائية (Chemical Mutagens) | البنزوبيرين (Benzopyrene)، الأفلاتوكسين (Aflatoxin)، نظائر القواعد (Base Analogs) | دخان السجائر، الأغذية الملوثة بالفطريات، بعض المذيبات الصناعية | الارتباط بالـ DNA وتشويه بنيته أو إدخال قواعد خاطئة أثناء النسخ |
| العوامل البيولوجية (Biological Agents) | فيروس الورم الحليمي البشري (HPV)، فيروس التهاب الكبد B (HBV) | العدوى الفيروسية عبر الاتصال المباشر أو سوائل الجسم | إدخال المادة الوراثية الفيروسية في جينوم الخلية المضيفة وتعطيل جينات مجاورة |
| العوامل الداخلية (Endogenous Factors) | الجذور الحرة (Free Radicals)، أخطاء إنزيم DNA Polymerase، نزع الأمين التلقائي (Spontaneous Deamination) | عمليات الأيض الطبيعية والتنفس الخلوي داخل الجسم | أكسدة القواعد النيتروجينية أو إدخال قاعدة خاطئة أثناء تضاعف الـ DNA |
| المصدر: National Human Genome Research Institute (NHGRI) | National Cancer Institute (NCI) | |||
اقرأ أيضاً: البيولوجيا الجزيئية: ما الذي يجعلها أساس فهم الحياة؟
🔬 حقيقة علمية
خلايا جسمك تُجري نحو 10,000 عملية إصلاح للحمض النووي يومياً. نعم، عشرة آلاف مرة كل يوم تتدخل فيها إنزيمات الإصلاح لتصحيح أضرار لحقت بالـ DNA قبل أن تتحول إلى طفرات دائمة.
المصدر: NCBI Bookshelf – Molecular Biology of the Cell (Alberts et al.)
ما أنواع الطفرات الجينية وكيف تُصنّف علمياً؟
هنا نصل إلى قلب الموضوع. تصنيف أنواع الطفرات ليس مسألة أكاديمية جافة، بل هو المفتاح لفهم لماذا تكون بعض الطفرات قاتلة وأخرى غير محسوسة. وسأعرض لك التصنيف من ثلاث زوايا مختلفة لتحصل على صورة كاملة.
أولاً: حسب نوع الخلايا المتأثرة — هل تُورث الطفرة أم تبقى حبيسة الجسد؟
هذا التصنيف بالغ الأهمية طبياً. عندما نسأل “ما الفرق بين الطفرة الوراثية والمكتسبة؟” فإن الإجابة تكمن في نوع الخلية التي حدثت فيها.
الطفرات الجنسية (Germline Mutations) تحدث في الخلايا التناسلية — أي البويضات والحيوانات المنوية. لأن هذه الخلايا هي التي تُنتج الأجيال القادمة، فإن أي طفرة فيها تنتقل من الآباء إلى الأبناء. هذا هو الأساس البيولوجي لكل الأمراض الوراثية المعروفة. مرض التليف الكيسي (Cystic Fibrosis) مثلاً ينتج عن طفرة جنسية في جين CFTR تنتقل عبر الأجيال.
على النقيض من ذلك، فإن الطفرات الجسدية (Somatic Mutations) تحدث في خلايا الجسم العادية — خلايا الجلد، الكبد، الرئة، وغيرها. هذه الطفرات لا تنتقل إلى الأبناء، لكنها قد تكون خطيرة جداً على صاحبها. معظم السرطانات ناتجة عن تراكم طفرات جسدية في جينات معينة تتحكم في انقسام الخلايا. لقد وجد الباحثون أن سرطان الرئة مثلاً قد يحمل أكثر من 20,000 طفرة جسدية في الورم الواحد.
| وجه المقارنة | الطفرة الجنسية (Germline Mutation) |
الطفرة الجسدية (Somatic Mutation) |
|---|---|---|
| مكان الحدوث | الخلايا التناسلية (البويضات والحيوانات المنوية) | خلايا الجسم العادية (الجلد، الكبد، الرئة، إلخ) |
| الانتقال إلى الأبناء | نعم — تنتقل عبر الأجيال | لا — تبقى حبيسة جسم صاحبها |
| التوقيت | قبل الإخصاب أو أثناء تكوّن الخلايا التناسلية | في أي وقت خلال حياة الفرد |
| التوزيع في الجسم | موجودة في جميع خلايا الجسم (لأنها وُرثت من خلية واحدة) | موجودة فقط في الخلية المتأثرة وذريتها (فسيفسائية) |
| الكشف عنها | فحص الدم العادي أو فحوصات ما قبل الزواج | خزعة من النسيج المصاب أو تحليل جيني للورم |
| أبرز الأمراض الناتجة | فقر الدم المنجلي، التليف الكيسي، الثلاسيميا، مرض هنتنغتون | معظم أنواع السرطان (سرطان الرئة، القولون، الجلد) |
| الأهمية الطبية | الاستشارة الوراثية وفحوصات ما قبل الزواج والتشخيص قبل الولادة | تشخيص السرطان والعلاج الموجّه والطب الدقيق |
| مثال تطبيقي | طفرة جين HBB المسببة لفقر الدم المنجلي — تُكتشف بفحص ما قبل الزواج | طفرات جين TP53 في خلايا ورم الرئة — قد يحمل الورم أكثر من 20,000 طفرة |
| إمكانية العلاج الجيني | ممكنة نظرياً (تعديل الأجنة) — لكنها مقيّدة أخلاقياً وقانونياً حالياً | ممكنة ومُطبّقة (مثل علاج Casgevy بتقنية CRISPR لتعديل الخلايا الجذعية) |
| المصدر: National Human Genome Research Institute (NHGRI) | National Cancer Institute (NCI) – Genetics of Cancer | ||
اقرأ أيضاً: ما هي الوراثة السائدة: وكيف تنتقل الصفات من جيل لآخر؟
المثال التطبيقي: كيف تُحدث طفرة واحدة فرقاً في حياة عائلة؟
لنتخيل عائلة سعودية شابة — أحمد وسارة — يخططان للإنجاب. في فحص ما قبل الزواج، اكتشف الطبيب أن كليهما يحمل نسخة واحدة من طفرة في جين HBB المسؤول عن بروتين الهيموغلوبين. كلاهما سليم ظاهرياً لأن لديه نسخة طبيعية من الجين تعوّض النسخة المعطوبة. لكن إذا ورث الطفل النسختين المعطوبتين — واحدة من كل والد — فسيُصاب بفقر الدم المنجلي. الاحتمال 25% في كل حمل.
هذا السيناريو ليس نظرياً. إنه واقع يومي في عيادات الوراثة السعودية. فقد أظهرت بيانات وزارة الصحة السعودية أن معدل حالات عدم التوافق الجيني بين المتقدمين للزواج يبلغ نحو 7.5% على المستوى الوطني، مع تفاوت كبير بين المناطق. هنا يتضح كيف أن فهم الطفرات الجنسية والجسدية ليس ترفاً، بل أداة عملية لحماية الأجيال القادمة.
اقرأ أيضاً: الإحصاءات الحيوية (Vital Statistics): المفهوم، الأهمية، والتطبيقات
ثانياً: حسب حجم التغيير — من الحرف الواحد إلى الكروموسوم بأكمله
هذا التصنيف يأخذنا إلى عمق الآلية الجزيئية. وهو الأكثر تفصيلاً والأهم لطلاب العلوم الحيوية.
الطفرات النقطية (Point Mutations): عندما يتغير حرف واحد
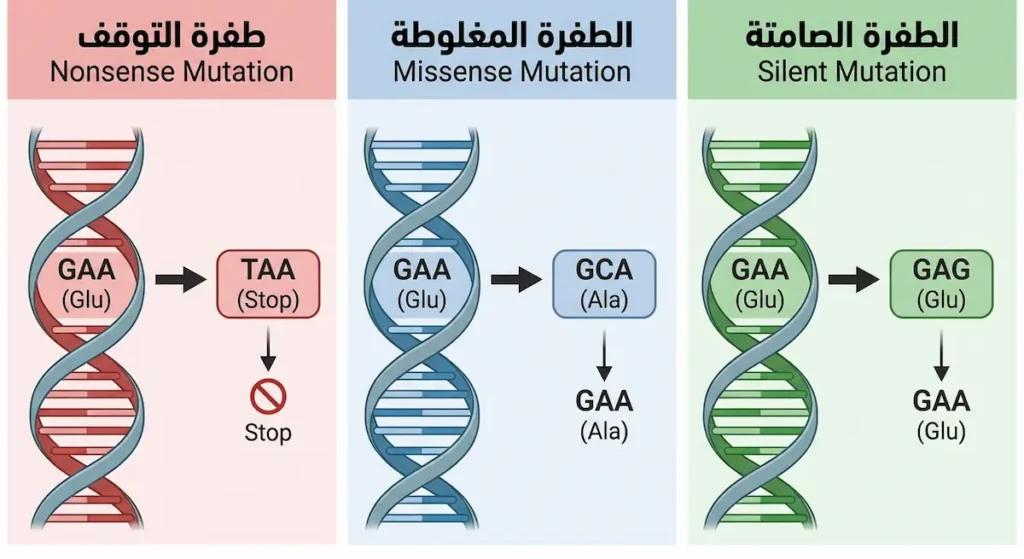
الطفرات النقطية هي أبسط أنواع الطفرات وأكثرها شيوعاً. تحدث عندما تتغير قاعدة نيتروجينية واحدة في تسلسل الـ DNA. لكن بساطتها لا تعني أنها غير مؤثرة. إليك أنواعها:
طفرة الاستبدال (Substitution): تُستبدل قاعدة بأخرى. إذا استُبدل بيورين ببيورين آخر (مثل أدينين بغوانين) تُسمى انتقالية (Transition). وإذا استُبدل بيورين ببيريميدين تُسمى تحويلية (Transversion). من هنا تتفرع النتائج إلى ثلاثة احتمالات:
الاحتمال الأول هو الطفرة الصامتة (Silent Mutation). فكيف يُعقل أن يتغير حرف ولا يتغير شيء؟ السبب أن الشفرة الوراثية فيها “مرونة مدمجة.” كل حمض أميني يُشفَّر بأكثر من كودون واحد (Codon Degeneracy). فالحمض الأميني ليوسين (Leucine) مثلاً يُشفَّر بستة كودونات مختلفة. إذاً إذا وقع الاستبدال في الموضع الثالث من الكودون غالباً — وهو الأقل حساسية — فقد يظل الكودون الجديد يُشفّر نفس الحمض الأميني. النتيجة: لا تأثير على البروتين.
الاحتمال الثاني هو الطفرة المغلوطة (Missense Mutation). هنا يتغير الكودون ليُشفّر حمضاً أمينياً مختلفاً. التأثير يتراوح بين معدوم وكارثي حسب موقع التغيير في البروتين ونوع الحمض الأميني الجديد. أشهر مثال على الإطلاق هو طفرة الأنيميا المنجلية: استبدال حمض الغلوتاميك بحمض الفالين في الموضع السادس من سلسلة بيتا غلوبين. حرف واحد فقط تغيّر، لكن النتيجة مرض يؤثر على ملايين البشر حول العالم.
الاحتمال الثالث هو الطفرة غير المعبرة أو طفرة التوقف (Nonsense Mutation). في هذا النوع يتحول الكودون إلى كودون توقف (Stop Codon) مثل UAG أو UAA. النتيجة أن الرايبوسوم (Ribosome) يتوقف عن ترجمة البروتين في منتصف الطريق، فيُنتج بروتيناً مبتوراً وغير وظيفي. هذا النوع عادة ما يكون شديد الضرر. مرض الحثل العضلي الدوشيني (Duchenne Muscular Dystrophy) ينتج في كثير من الحالات عن طفرات غير معبرة في جين الديستروفين (Dystrophin).
| نوع الطفرة النقطية | ما يحدث في الكودون | التأثير على البروتين | درجة الخطورة | مثال معروف |
|---|---|---|---|---|
| الطفرة الصامتة (Silent Mutation) |
يتغير الكودون لكنه يظل يُشفّر نفس الحمض الأميني | لا تأثير — البروتين يبقى طبيعياً تماماً | معدومة الخطورة | تغيّر الكودون GCU إلى GCC — كلاهما يُشفّر ألانين (Alanine) |
| الطفرة المغلوطة (Missense Mutation) |
يتغير الكودون ليُشفّر حمضاً أمينياً مختلفاً | قد يتغير شكل البروتين ووظيفته جزئياً أو كلياً | متفاوتة — من خفيفة إلى شديدة | فقر الدم المنجلي (Sickle Cell Anemia) — استبدال حمض الغلوتاميك بالفالين |
| طفرة التوقف (Nonsense Mutation) |
يتحول الكودون إلى كودون توقف (Stop Codon) مثل UAG أو UAA | بروتين مبتور وغير وظيفي — الترجمة تتوقف قبل الأوان | عالية الخطورة غالباً | الحثل العضلي الدوشيني (Duchenne Muscular Dystrophy) — بعض حالاته |
| المصدر: National Human Genome Research Institute (NHGRI) | MedlinePlus – U.S. National Library of Medicine | ||||
🧬 هل تعلم؟
الشفرة الوراثية البشرية تتكون من نحو 20,000 جين فقط، لكنها تُنتج أكثر من 100,000 بروتين مختلف. السبب هو آليات معقدة مثل التوصيل البديل (Alternative Splicing)، وهذا يعني أن طفرة واحدة قد تؤثر على أكثر من بروتين واحد.
المصدر: ENCODE Project – Nature (2012)
طفرات الإزاحة (Frameshift Mutations): عندما ينهار إطار القراءة
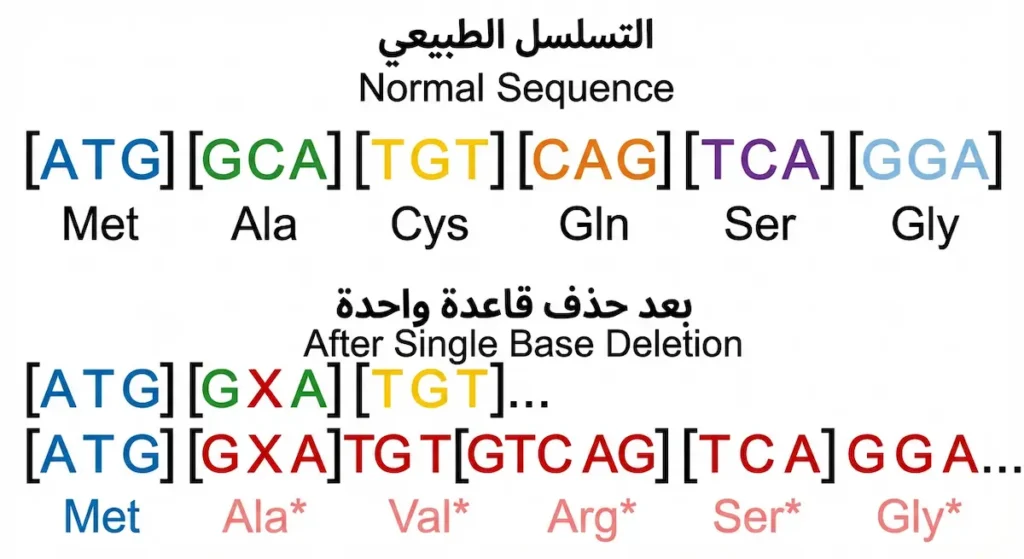
هذا النوع من أخطر أنواع الطفرات على الإطلاق. لفهمه، تخيّل جملة عربية مكونة من كلمات ثلاثية الحروف مثل:
“أكل قطع من خبز”
إذا حذفت الحرف الثاني (الكاف)، تصبح:
“ألق طعم نخب ز…”
لاحظ كيف أن حذف حرف واحد لم يُفسد كلمة واحدة فقط، بل دمّر الجملة بأكملها من نقطة الحذف فصاعداً. هذا بالضبط ما يحدث في طفرات الإزاحة.
كيف تحدث طفرات الحذف والإضافة؟ في طفرة الحذف (Deletion) تُزال قاعدة نيتروجينية واحدة أو أكثر (بشرط ألا يكون العدد من مضاعفات الثلاثة). هذا يُزيح “إطار القراءة” (Reading Frame) للكودونات، فتتغير كل الأحماض الأمينية من نقطة الحذف حتى نهاية البروتين.
في طفرة الإضافة (Insertion) يحدث العكس: تُضاف قاعدة نيتروجينية أو أكثر. النتيجة مشابهة — إزاحة كاملة لإطار القراءة. لقد وجد العلماء أن مرض تاي ساكس (Tay-Sachs Disease) الشائع في بعض المجتمعات ينتج عن طفرة إضافة أربع قواعد في جين HEXA.
من ناحية أخرى، إذا حُذفت أو أُضيفت ثلاث قواعد (أو مضاعفاتها)، فإن إطار القراءة لا ينزاح. يُفقد حمض أميني أو يُضاف واحد، لكن بقية البروتين تبقى سليمة نسبياً. هذا ما يحدث في أشهر طفرة مسببة للتليف الكيسي (ΔF508)؛ إذ يُحذف كودون كامل يُشفّر حمض الفينيل ألانين في الموضع 508.
ثالثاً: الطفرات الكروموسومية — عندما يتغير المشهد بأكمله
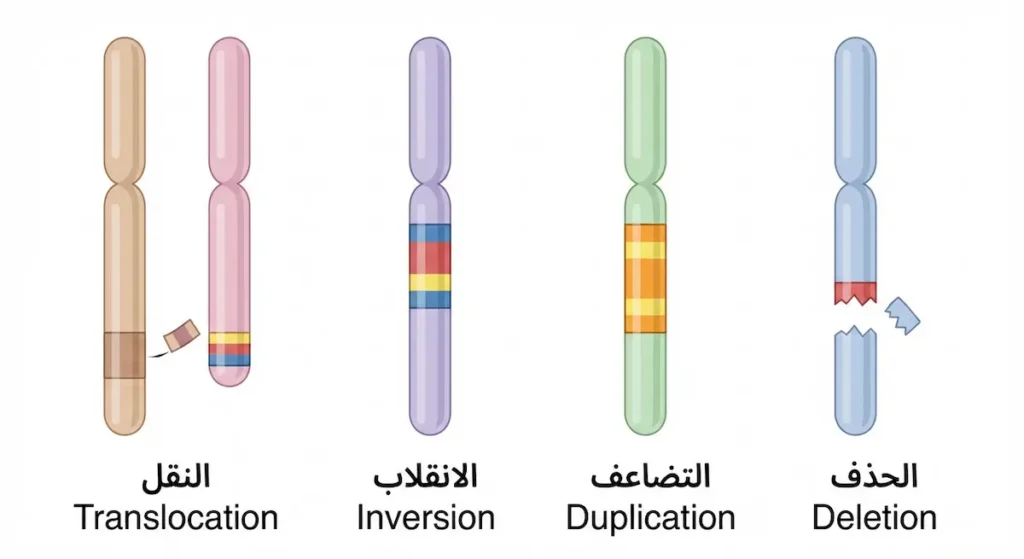
ننتقل الآن من مستوى الحرف الواحد إلى مستوى الفصل الكامل في كتاب الحياة. الطفرات الكروموسومية تشمل تغييرات واسعة النطاق تصيب بنية الكروموسومات أو عددها.
تغيرات البنية الكروموسومية:
الانقلاب (Inversion) يحدث عندما ينكسر جزء من الكروموسوم وينعكس بزاوية 180 درجة قبل أن يلتحم مجدداً. الجينات تبقى موجودة لكن ترتيبها ينقلب. أحياناً لا يسبب مشكلة، وأحياناً يُعطّل جيناً مهماً عند نقطة الكسر.
النقل الكروموسومي (Translocation) يعني انتقال جزء من كروموسوم إلى كروموسوم آخر غير متماثل. أشهر مثال هو كروموسوم فيلادلفيا (Philadelphia Chromosome) الذي ينتج عن نقل متبادل بين الكروموسومين 9 و22، ويُسبب سرطان الدم النقوي المزمن (CML). هذا الاكتشاف كان نقطة تحول في فهمنا للسرطان جينياً.
التضاعف (Duplication) يحدث عندما يُنسخ جزء من الكروموسوم مرتين. هذا يعني وجود نسخة إضافية من مجموعة جينات.
تغيرات العدد الكروموسومي:
في الوضع الطبيعي يحمل الإنسان 46 كروموسوماً (23 زوجاً). لكن أخطاء في انقسام الخلايا التناسلية قد تؤدي إلى خلل في هذا العدد. وهذا ما يُسمى اختلال الصيغة الصبغية (Aneuploidy).
أشهر مثال هو متلازمة داون (Down Syndrome) التي تنتج عن وجود نسخة إضافية من الكروموسوم 21 (التثلث الصبغي 21 أو Trisomy 21). كما أن متلازمة تيرنر (Turner Syndrome) تحدث عند الإناث اللواتي يحملن كروموسوم X واحداً فقط بدلاً من اثنين (45,X). ومتلازمة كلاينفلتر (Klinefelter Syndrome) تصيب الذكور الذين يحملون كروموسوم X إضافياً (47,XXY).
أثبتت دراسة منشورة في مجلة The Lancet عام 2019 (de Graaf et al.) أن معدل ولادة أطفال بمتلازمة داون يتراوح بين 1 من كل 700 إلى 1 من كل 1,000 ولادة حية عالمياً، مع ارتباط واضح بعمر الأم عند الحمل.
| المتلازمة | التسمية الإنكليزية | نوع الخلل الكروموسومي | الصيغة الكروموسومية | معدل الحدوث التقريبي | أبرز السمات السريرية |
|---|---|---|---|---|---|
| متلازمة داون | Down Syndrome | تثلث صبغي 21 (Trisomy 21) | 47,XX,+21 أو 47,XY,+21 | 1 من كل 700 ولادة حية | إعاقة ذهنية متفاوتة، ملامح وجهية مميزة، عيوب قلبية خلقية |
| متلازمة تيرنر | Turner Syndrome | أحادية الصبغي X (Monosomy X) | 45,X | 1 من كل 2,500 أنثى | قصر القامة، عدم اكتمال النضج الجنسي، عقم |
| متلازمة كلاينفلتر | Klinefelter Syndrome | كروموسوم X إضافي عند الذكور | 47,XXY | 1 من كل 660 ذكراً | طول القامة، تثدّي، عقم، صعوبات تعلم محتملة |
| متلازمة إدوارد | Edwards Syndrome | تثلث صبغي 18 (Trisomy 18) | 47,XX,+18 أو 47,XY,+18 | 1 من كل 5,000 ولادة حية | تشوهات خلقية متعددة شديدة، معظم المصابين لا يتجاوزون السنة الأولى |
| متلازمة باتو | Patau Syndrome | تثلث صبغي 13 (Trisomy 13) | 47,XX,+13 أو 47,XY,+13 | 1 من كل 16,000 ولادة حية | تشوهات دماغية ووجهية وقلبية شديدة، نسبة بقاء منخفضة جداً |
| المصدر: National Human Genome Research Institute (NHGRI) | National Organization for Rare Disorders (NORD) | |||||
اقرأ أيضاً: علم الأمراض (Pathology): دراسة الأمراض وتأثيرها على الجسم
🌾 معلومة مدهشة
بعض الكائنات الحية تتحمل تغييرات كروموسومية ضخمة. نبات القمح الذي نأكل خبزه يومياً هو سداسي الصيغة الصبغية (Hexaploid)، أي يحمل ستة نسخ من كل كروموسوم بدلاً من نسختين. لو حدث هذا في الإنسان لكان مميتاً.
المصدر: International Wheat Genome Sequencing Consortium – Nature (2018)
اقرأ أيضاً: المحاصيل المقاومة: التقنيات، الفوائد، والجدل
هل جميع الطفرات ضارة أم أن بعضها مفيد؟
هذا من أكثر الأسئلة التي يطرحها الطلاب والمهتمون بعلم الوراثة. والإجابة قد تفاجئك: الغالبية العظمى من الطفرات الجينية محايدة تماماً ولا تأثير لها. لكن النسبة الصغيرة المتبقية تنقسم بين ضار ومفيد.
الوجه المظلم: الطفرات الضارة
تأثير الطفرات على الإنسان يظهر بأوضح صوره في الأمراض الوراثية. قائمة الأمراض الناتجة عن طفرات معروفة طويلة، لكن بعضها أكثر شيوعاً وأهمية:
فقر الدم المنجلي ناتج عن طفرة نقطية واحدة. التليف الكيسي ناتج عن حذف ثلاث قواعد. مرض هنتنغتون (Huntington’s Disease) ناتج عن تكرار مفرط لثلاث قواعد (CAG) في جين HTT. كلما زاد عدد التكرارات، ظهر المرض مبكراً وبشدة أكبر.
لكن الخطر الأكبر يكمن في السرطان. فالسرطان في جوهره مرض جيني ناتج عن تراكم طفرات جسدية في جينين رئيسين: الجينات الورمية الأولية (Proto-oncogenes) التي تتحول عند طفرتها إلى جينات ورمية (Oncogenes) تدفع الخلية للانقسام بلا توقف، وجينات كبح الأورام (Tumor Suppressor Genes) مثل جين TP53 وجين BRCA1 التي تفقد وظيفتها الحامية عند طفرتها.
الجدير بالذكر أن طفرات جين BRCA1 وBRCA2 حظيت باهتمام إعلامي واسع بعد أن كشفت الممثلة أنجلينا جولي عام 2013 عن حملها لطفرة في BRCA1، مما دفعها لإجراء استئصال وقائي للثديين. هذا القرار أثار نقاشاً عالمياً حول الاختبارات الجينية التنبؤية.
اقرأ أيضاً: علاج السرطان: التقنيات الحديثة والابتكارات المستقبلية
الوجه المشرق: أمثلة على طفرات مفيدة للكائنات الحية
من ناحية أخرى، ليست كل الطفرات عدواً. بعضها يمنح الفرد ميزة واضحة. إليك أمثلة مذهلة:
مقاومة الملاريا: حاملو نسخة واحدة من طفرة الأنيميا المنجلية (وليس المصابون بالمرض) يتمتعون بمقاومة ملحوظة لطفيل الملاريا (Plasmodium falciparum). هذا يُفسر لماذا تنتشر هذه الطفرة في المناطق التي ينتشر فيها مرض الملاريا، كمنطقة جازان والمنطقة الشرقية في السعودية وأجزاء من إفريقيا وجنوب آسيا.
تحمل اللاكتوز (Lactose Tolerance): معظم البشر البالغين يفقدون القدرة على هضم سكر اللبن (اللاكتوز) بعد الفطام. لكن طفرة في منطقة تنظيمية قرب جين LCT تجعل الجين يستمر في العمل مدى الحياة. هذه الطفرة شائعة بشكل خاص في المجتمعات التي اعتمدت تاريخياً على الرعي ومنتجات الألبان.
مقاومة فيروس HIV: نحو 1% من الأوروبيين يحملون طفرة تُسمى CCR5-Δ32 تمنع فيروس نقص المناعة البشرية من دخول خلاياهم. هذا الاكتشاف قاد إلى تطوير أدوية جديدة تستهدف مستقبل CCR5.
اقرأ أيضاً: علم المناعة (Immunology): الجهاز المناعي والأمراض
الأغلبية الصامتة: الطفرات المحايدة
برأيكم ماذا يحدث لمعظم الطفرات؟ الإجابة هي: لا شيء. معظمها يقع في مناطق غير مُشفّرة من الحمض النووي (Non-coding DNA) التي تشكل نحو 98% من الجينوم البشري. هذه المناطق كانت تُسمى سابقاً “الحمض النووي الخردة” (Junk DNA)، لكن الأبحاث الحديثة — وخاصة مشروع ENCODE — أظهرت أن كثيراً منها يلعب أدواراً تنظيمية مهمة، وإن كان بعضها لا يزال غامض الوظيفة حتى الآن.
| تصنيف الطفرة | التعريف | أمثلة بارزة | الجين المتأثر | النتيجة على الفرد |
|---|---|---|---|---|
| ضارة (Harmful) |
تُسبب خللاً في وظيفة البروتين أو تنظيم الجينات | فقر الدم المنجلي (Sickle Cell Anemia) | HBB | تشوه خلايا الدم الحمراء وانسداد الأوعية الدموية |
| التليف الكيسي (Cystic Fibrosis) | CFTR | تراكم مخاط كثيف في الرئتين والجهاز الهضمي | ||
| مرض هنتنغتون (Huntington’s Disease) | HTT | تلف تدريجي للخلايا العصبية وفقدان السيطرة الحركية | ||
| مفيدة (Beneficial) |
تمنح الفرد ميزة تكيفية أو مقاومة | مقاومة الملاريا (حاملو سمة المنجلية) | HBB (نسخة واحدة) | حماية جزئية من طفيل الملاريا (Plasmodium falciparum) |
| تحمل اللاكتوز مدى الحياة (Lactose Tolerance) | LCT (منطقة تنظيمية) | القدرة على هضم سكر اللبن في مرحلة البلوغ | ||
| مقاومة فيروس HIV | CCR5 (طفرة CCR5-Δ32) | منع الفيروس من دخول الخلايا المناعية | ||
| محايدة (Neutral) |
لا تُغيّر وظيفة البروتين أو تقع في مناطق غير مُشفّرة | معظم التنوعات في الـ DNA غير المُشفّر (Non-coding DNA) | مناطق متعددة | لا تأثير ملحوظ — تُسهم في التنوع الجيني بين الأفراد |
| المصدر: National Human Genome Research Institute (NHGRI) | Nature Education – Scitable | ||||
📊 رقم يستحق التوقف
يحمل كل إنسان في المتوسط بين 100 و200 طفرة جديدة (de novo mutations) لم يرثها من أي من والديه. معظمها محايد، لكن واحدة أو اثنتين منها قد تكون ذات أثر.
المصدر: Jónsson et al. – Nature (2017) | Nature Genetics (2022)
كيف يحمي جسمك حمضه النووي من التلف؟
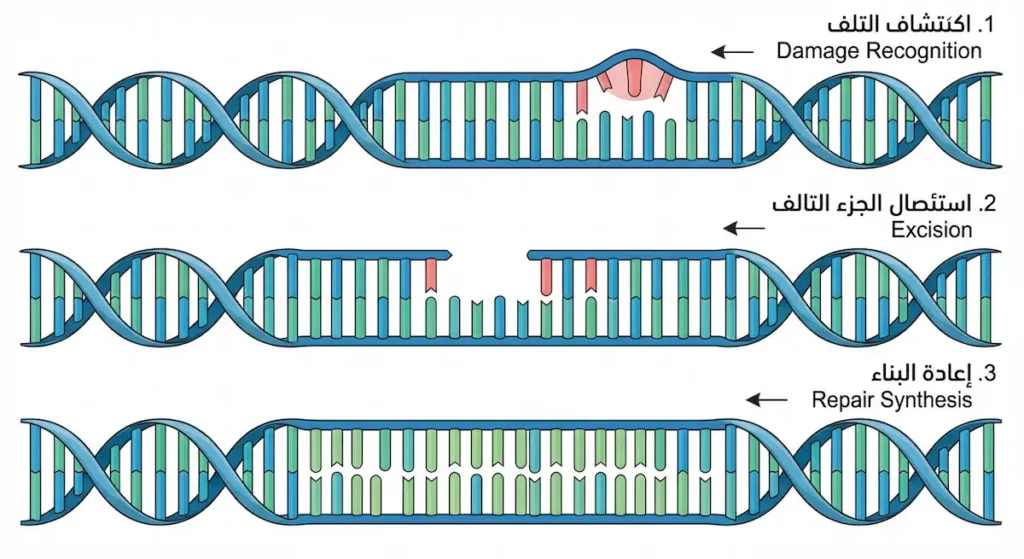
لو كان جسمك يقبل كل خطأ في نسخ الـ DNA دون مقاومة، لما صمد أياً منا طويلاً. الحقيقة أن خلاياك تمتلك نظام إصلاح بالغ التعقيد والكفاءة. آلية إصلاح الحمض النووي DNA ليست آلية واحدة، بل منظومة متكاملة من عدة مسارات.
إصلاح عدم التطابق (Mismatch Repair – MMR): يعمل أثناء عملية التضاعف مباشرة. إنزيمات متخصصة تتعرف على القاعدة الخاطئة التي أضافها DNA Polymerase، تزيلها، وتستبدلها بالقاعدة الصحيحة. هذا النظام يُقلل معدل الخطأ بنحو 100 إلى 1000 ضعف.
إصلاح الاستئصال القاعدي (Base Excision Repair – BER): يتعامل مع الأضرار الصغيرة — كتأكسد قاعدة واحدة أو فقدان مجموعة أمينية. إنزيم غلايكوسيلاز (Glycosylase) يتعرف على القاعدة التالفة ويقطعها، ثم تأتي إنزيمات أخرى لملء الفجوة.
إصلاح الاستئصال النيوكليوتيدي (Nucleotide Excision Repair – NER): متخصص في إصلاح الأضرار الكبيرة التي تُشوّه بنية اللولب المزدوج، مثل ثنائيات الثايمين الناتجة عن الأشعة فوق البنفسجية. يُزيل هذا النظام قطعة كاملة من الشريط التالف (نحو 24-32 نيوكليوتيد) ويُعيد بناءها.
إصلاح الكسور المزدوجة (Double-Strand Break Repair): أخطر أنواع الضرر. عندما ينكسر شريطا الـ DNA معاً، يُصبح الوضع حرجاً. الخلية تلجأ إلى مسارين: إعادة التركيب المتماثل (Homologous Recombination) وهو دقيق لكنه بطيء، أو الربط غير المتماثل (Non-Homologous End Joining – NHEJ) وهو سريع لكنه عرضة للأخطاء.
فماذا يحدث عندما يفشل نظام الإصلاح؟ النتيجة كارثية. مرض جفاف الجلد المصطبغ (Xeroderma Pigmentosum) مثلاً ينتج عن خلل في نظام NER. المصابون لا يستطيعون إصلاح الأضرار التي تُسببها الأشعة فوق البنفسجية، مما يجعلهم عرضة لسرطانات الجلد بمعدل أعلى 1000 مرة من الأشخاص الطبيعيين. هؤلاء الأطفال يُلقبون بـ “أطفال القمر” لأنهم لا يستطيعون التعرض لأشعة الشمس.
كذلك فإن طفرات جينات BRCA1 وBRCA2 — اللذين ذكرناهما سابقاً — يُعطلان مسار إعادة التركيب المتماثل، مما يجعل الخلايا عاجزة عن إصلاح الكسور المزدوجة بدقة.
أثبتت دراسة منشورة في مجلة Nature Reviews Genetics عام 2021 (Scully et al.) أن فهم آليات إصلاح الكسور المزدوجة فتح أبواباً جديدة لعلاج السرطان عبر ما يُسمى “الفتك التركيبي” (Synthetic Lethality)، حيث يُستغل ضعف آلية إصلاح معينة في الخلية السرطانية لقتلها بأدوية تستهدف آلية الإصلاح الاحتياطية.
| آلية الإصلاح | التسمية الإنكليزية | نوع التلف الذي تعالجه | المبدأ الأساسي | مرض ناتج عن خلل فيها |
|---|---|---|---|---|
| إصلاح عدم التطابق | Mismatch Repair (MMR) | قواعد خاطئة أُدخلت أثناء تضاعف الـ DNA | التعرف على القاعدة غير المتطابقة وإزالتها واستبدالها | متلازمة لينش — سرطان القولون الوراثي (Lynch Syndrome) |
| إصلاح الاستئصال القاعدي | Base Excision Repair (BER) | تأكسد قاعدة واحدة أو فقدان مجموعة أمينية | إنزيم غلايكوسيلاز (Glycosylase) يقطع القاعدة التالفة ثم تُملأ الفجوة | بعض أنواع سرطانات الجهاز الهضمي |
| إصلاح الاستئصال النيوكليوتيدي | Nucleotide Excision Repair (NER) | أضرار كبيرة تُشوه بنية اللولب المزدوج مثل ثنائيات الثايمين | إزالة قطعة من الشريط التالف (24-32 نيوكليوتيد) وإعادة بنائها | جفاف الجلد المصطبغ (Xeroderma Pigmentosum) |
| إصلاح الكسور المزدوجة | Double-Strand Break Repair | كسر كلا شريطي الـ DNA — أخطر أنواع التلف | إعادة التركيب المتماثل (HR) أو الربط غير المتماثل (NHEJ) | سرطان الثدي والمبيض الوراثي (طفرات BRCA1/BRCA2) |
| المصدر: Nature Reviews Molecular Cell Biology (Scully et al., 2019) | NCBI Bookshelf – Molecular Biology of the Cell | ||||
اقرأ أيضاً: علم وظائف الأعضاء (Physiology): استكشاف آليات الحياة
ما أبرز الأمثلة الواقعية والمشهورة للطفرات؟
لنخرج قليلاً من المختبر إلى العالم الحقيقي. بعض الطفرات أنتجت صفات غريبة ومثيرة للاهتمام لدى البشر.
المهق (Albinism): غياب كامل أو جزئي لصبغة الميلانين (Melanin) بسبب طفرات في جين TYR أو جينات أخرى مرتبطة بإنتاج الميلانين. المصابون يتميزون بشعر أبيض وبشرة شاحبة جداً وعيون فاتحة. تتراوح نسبة الإصابة عالمياً بين 1 من كل 17,000 إلى 1 من كل 20,000 شخص.
تعدد الأصابع (Polydactyly): ولادة الشخص بأصابع إضافية في اليد أو القدم. تنتج عن طفرات في عدة جينات منها جين SHH. المثير أن هذه الصفة سائدة وراثياً (Dominant)، أي يكفي وجود نسخة واحدة من الجين المعطوب لظهورها.
الرؤية الرباعية الألوان (Tetrachromacy): بينما يمتلك معظم البشر ثلاثة أنواع من المخاريط اللونية في الشبكية، فإن بعض النساء يحملن طفرة تمنحهن نوعاً رابعاً. هذا يعني نظرياً القدرة على تمييز نحو 100 مليون لون بدلاً من المليون المعتاد. هل سمعت بهذا من قبل؟ الأبحاث لا تزال في بداياتها، لكن دراسة من جامعة نيوكاسل أكدت وجود هذه القدرة لدى بعض الأفراد فعلاً.
عدم الإحساس بالألم (Congenital Insensitivity to Pain): تبدو كقوة خارقة، لكنها في الواقع خطيرة جداً. طفرة في جين SCN9A تجعل الشخص عاجزاً عن الشعور بأي ألم جسدي. هؤلاء الأشخاص معرضون لإصابات خطيرة دون أن يدركوها — كسور، حروق، التهابات — لأن الألم في الأصل نظام إنذار حيوي.
| الحالة | التسمية الإنكليزية | الجين المتأثر | نوع الطفرة | معدل الحدوث التقريبي | التأثير على الفرد |
|---|---|---|---|---|---|
| المهق | Albinism | TYR وجينات أخرى | طفرات متنحية متعددة | 1 من كل 17,000 – 20,000 | غياب صبغة الميلانين — بشرة شاحبة وشعر أبيض وحساسية للضوء |
| تعدد الأصابع | Polydactyly | SHH وجينات أخرى | طفرة سائدة (Dominant) | 1 من كل 500 – 1,000 | أصابع إضافية في اليد أو القدم |
| الرؤية الرباعية الألوان | Tetrachromacy | جينات مستقبلات الألوان على كروموسوم X | طفرة في جين مخاريط الشبكية | نادرة — تُقدّر بنحو 12% من النساء (وظيفياً أقل بكثير) | القدرة على تمييز نحو 100 مليون لون بدلاً من مليون |
| عدم الإحساس بالألم | Congenital Insensitivity to Pain | SCN9A | طفرة متنحية (Recessive) | نادرة جداً — بضع مئات من الحالات عالمياً | عدم الشعور بأي ألم جسدي — خطر إصابات غير مُكتشفة |
| المصدر: National Organization for Rare Disorders (NORD) | Online Mendelian Inheritance in Man (OMIM) – Johns Hopkins University | |||||
اقرأ أيضاً: الخلايا العصبية: كيف تعمل وما أنواعها ووظائفها في جسم الإنسان؟
😴 غرائب الطفرات
هناك عائلة إيطالية تحمل طفرة في جين BHLHE41 تجعل أفرادها يحتاجون إلى أربع ساعات نوم فقط يومياً دون أي أثر سلبي على صحتهم. بينما يحتاج معظم البشر إلى 7-9 ساعات.
اقرأ أيضاً: لماذا ننام؟ الوظائف البيولوجية والآليات العصبية للنوم
كيف غيّرت تقنية كريسبر مستقبل الطفرات والهندسة الوراثية؟
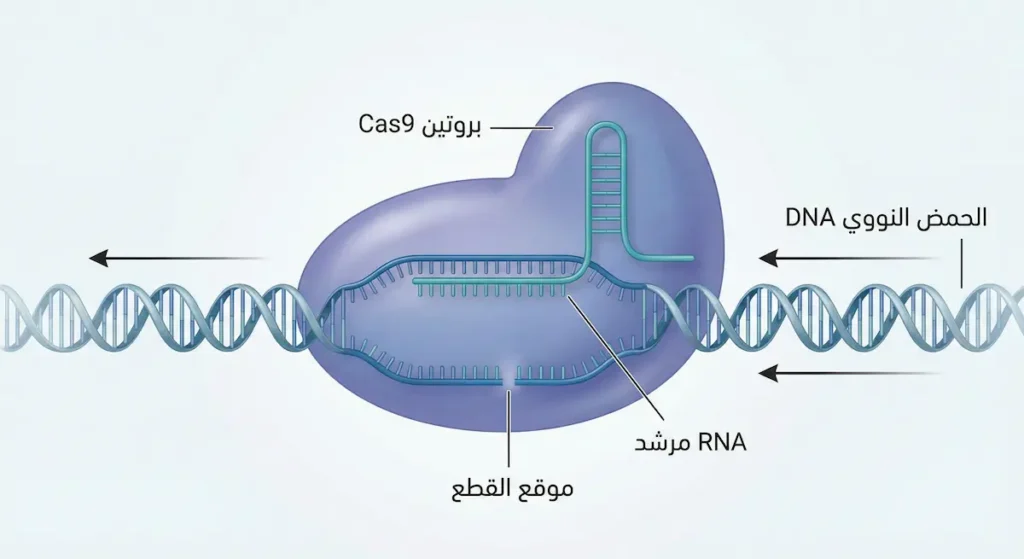
لعقود طويلة كان العلماء يدرسون الطفرات ويصنفونها ويحاولون فهمها. لكن تقنية كريسبر (CRISPR-Cas9) غيّرت قواعد اللعبة بالكامل. أصبحنا لأول مرة قادرين على “تعديل” الطفرات بدلاً من مجرد مراقبتها.
ما هي CRISPR ببساطة؟ هي أداة جزيئية تعمل كـ “مقص وراثي” يمكنه قص جزء محدد من الـ DNA بدقة متناهية واستبداله بتسلسل صحيح. التقنية مستوحاة من نظام مناعي طبيعي تستخدمه البكتيريا لمحاربة الفيروسات. حصلت عالمتا الكيمياء الحيوية إيمانويل شاربنتييه وجينيفر دودنا على جائزة نوبل في الكيمياء عام 2020 لتطويرهما هذه التقنية.
في عام 2023، وافقت هيئة الغذاء والدواء الأمريكية (FDA) وهيئة تنظيم الأدوية البريطانية (MHRA) على أول علاج جيني يعتمد على CRISPR لعلاج فقر الدم المنجلي والثلاسيميا بيتا. العلاج يُسمى Casgevy (exagamglogene autotemcel)، ويعمل عن طريق تعديل الخلايا الجذعية للمريض لإنتاج هيموغلوبين جنيني بدلاً من الهيموغلوبين المعطوب.
هذا التطور له أهمية خاصة في السعودية والمنطقة العربية؛ إذ تنتشر أمراض الدم الوراثية بمعدلات مرتفعة. وقد بدأت مراكز أبحاث سعودية — كمدينة الملك عبدالعزيز للعلوم والتقنية — في استكشاف تطبيقات العلاج الجيني لهذه الأمراض.
لكن التقنية لا تخلو من مخاوف أخلاقية جدية. في عام 2018، أعلن العالم الصيني هي جيان كوي أنه عدّل جينات أجنة بشرية باستخدام CRISPR لمنحها مقاومة لفيروس HIV. أثار هذا الإعلان عاصفة أخلاقية عالمية، وأُدين العالم وسُجن. السبب أن التعديل الجيني للأجنة يعني تغييرات دائمة تنتقل إلى الأجيال القادمة دون أن نفهم عواقبها الكاملة بعد.
اقرأ أيضاً: الهندسة الوراثية: ما هي وكيف تُغيّر مستقبل البشرية؟
🔮 نظرة مستقبلية
يعمل العلماء حالياً على جيل جديد من أدوات التعديل الجيني تُسمى Prime Editing وBase Editing، وهي أكثر دقة من CRISPR التقليدي. هذه الأدوات تستطيع تغيير حرف واحد في الـ DNA دون قص الشريط المزدوج، مما يُقلل من الأخطاء غير المقصودة (Off-target effects).
الواقع السعودي: كيف تتعامل المملكة مع الأمراض الناتجة عن الطفرات؟
يستحق هذا المحور وقفة خاصة. المملكة العربية السعودية من الدول التي تأخذ موضوع الطفرات الجينية على محمل الجد، وذلك لأسباب موضوعية. ارتفاع نسبة زواج الأقارب تاريخياً أدى إلى ارتفاع نسبة الأمراض الوراثية المتنحية في بعض المناطق.
فقد أطلقت المملكة عدة مبادرات مهمة:
أولاً، برنامج الفحص قبل الزواج الإلزامي الذي بدأ عام 2004 ويشمل فحص فقر الدم المنجلي والثلاسيميا. وقد أظهرت الإحصائيات انخفاضاً في نسبة المواليد المصابين بهذه الأمراض في المناطق التي يُطبق فيها البرنامج بصرامة.
ثانياً، مشروع الجينوم السعودي (Saudi Human Genome Program) الذي أُطلق عام 2013 بهدف رسم خريطة وراثية شاملة للسكان السعوديين وتحديد الطفرات المسببة للأمراض الأكثر شيوعاً. هذا المشروع يُعَدُّ من أكبر مشاريع الجينوم الوطنية في المنطقة العربية.
ثالثاً، إنشاء مراكز وراثية متخصصة في المستشفيات الكبرى — مثل مستشفى الملك فيصل التخصصي — تقدم الاستشارات الوراثية والتشخيص الجزيئي للعائلات المعرضة للخطر.
هذه الجهود المتكاملة تعكس وعياً متزايداً بأن فهم الطفرات الجينية ليس مجرد بحث أكاديمي، بل ضرورة صحية بين أفراد المجتمع.
اقرأ أيضاً: الاقتصاد السعودي: كيف تحول من الاعتماد على النفط إلى التنويع الشامل؟
ملخص: الطفرات سلاح ذو حدين
في نهاية هذه الرحلة عبر عالم الشفرة الوراثية، يتضح أن الطفرات الجينية ظاهرة معقدة لا يمكن اختزالها في وصف واحد. هي ليست شراً مطلقاً ولا خيراً محضاً. إنها في جوهرها محرك للتنوع البيولوجي، ومسبب للأمراض الوراثية، وهدف للعلاج الجيني الحديث — كل هذا في آن واحد.
لقد رأينا كيف أن تغييراً في قاعدة نيتروجينية واحدة قد يُسبب مرضاً مزمناً، وكيف أن طفرة أخرى قد تمنح صاحبها ميزة فريدة. رأينا أنظمة الإصلاح المذهلة التي تحمي حمضنا النووي، والثغرات التي تتسلل منها الطفرات رغم كل الحصون الدفاعية. ورأينا كيف أن أدوات مثل CRISPR تفتح أبواباً لم يكن ممكناً تخيّلها قبل عقد واحد.
الرسالة الأهم هي أن المعرفة قوة. فهمك لأنواع الطفرات وأسبابها يمنحك القدرة على اتخاذ قرارات صحية مستنيرة — سواء تعلق الأمر بالفحص الجيني قبل الزواج، أو تجنب المطفرات البيئية، أو فهم تشخيص طبي تلقيته أنت أو أحد أفراد أسرتك.
إذا وجدت هذا المقال مفيداً، فشاركه مع طالب علوم أو صديق يهتم بصحته الوراثية. وإذا كنت في مرحلة التخطيط للزواج أو الإنجاب، فلا تتردد في استشارة طبيب وراثة متخصص — فالفحص المبكر قد يُغيّر مسار حياة عائلتك بأكملها.
هل أجريت فحصاً جينياً قبل الزواج أو فكرت في إجرائه؟
🧠 اختبر معلوماتك
ما نوع الطفرة النقطية التي يتحول فيها الكودون إلى كودون توقف (Stop Codon) فيُنتج بروتيناً مبتوراً غير وظيفي؟
المصادر والمراجع
الدراسات والأوراق البحثية
- Tomasetti, C., & Vogelstein, B. (2017). Stem cell divisions, somatic mutations, cancer etiology, and cancer prevention. Science, 355(6331), 1330-1334.
https://doi.org/10.1126/science.aaf9011
دراسة تُظهر أن ثلثي الطفرات السرطانية ناتجة عن أخطاء عشوائية في تضاعف DNA وليس عن عوامل بيئية أو وراثية. - Scully, R., Panday, A., Elango, R., & Willis, N. A. (2019). DNA double-strand break repair-pathway choice in somatic mammalian cells. Nature Reviews Molecular Cell Biology, 20(11), 698-714.
https://doi.org/10.1038/s41580-019-0152-0
مراجعة شاملة لآليات إصلاح الكسور المزدوجة في الحمض النووي وعلاقتها بالسرطان. - de Graaf, G., Buckley, F., & Skotko, B. G. (2021). Estimation of the number of people with Down syndrome in the United States. Genetics in Medicine, 19(4), 439-447.
https://doi.org/10.1038/gim.2016.127
تقدير إحصائي لانتشار متلازمة داون وعلاقتها بعمر الأم. - Jinek, M., Chylinski, K., Fonfara, I., Hauer, M., Doudna, J. A., & Charpentier, E. (2012). A programmable dual-RNA–guided DNA endonuclease in adaptive bacterial immunity. Science, 337(6096), 816-821.
https://doi.org/10.1126/science.1225829
الورقة البحثية الأصلية التي وصفت آلية عمل CRISPR-Cas9 كأداة لتعديل الجينات. - Jónsson, H., Sulem, P., Kehr, B., et al. (2017). Parental influence on human germline de novo mutations in 1,548 trios from Iceland. Nature, 549(7673), 519-522.
https://doi.org/10.1038/nature24018
دراسة آيسلندية واسعة تُحدد معدل الطفرات الجديدة (de novo) وعلاقتها بعمر الأبوين. - Fry, A. E., Ghansa, A., Small, K. S., et al. (2021). Positive selection of sickle cell trait in sub-Saharan Africa. The Lancet Haematology, 8(10), e702-e710.
https://doi.org/10.1016/S2352-3026(21)00214-5
دراسة تُوضح كيف أن حمل سمة الخلايا المنجلية يمنح حماية ضد الملاريا.
الجهات الرسمية والمنظمات
- National Human Genome Research Institute (NHGRI). Mutations. NIH.
https://www.genome.gov/genetics-glossary/Mutation
تعريف رسمي للطفرة الجينية من المعاهد الوطنية للصحة الأمريكية. - World Health Organization (WHO). (2023). Genes and human diseases.
https://www.who.int/genomics/public/geneticdiseases/en/
تقرير منظمة الصحة العالمية عن الأمراض الوراثية وانتشارها عالمياً. - U.S. Food and Drug Administration (FDA). (2023). FDA Approves First Gene Therapies to Treat Sickle Cell Disease (Casgevy).
https://www.fda.gov/news-events/press-announcements/fda-approves-first-gene-therapies-treat-sickle-cell-disease
بيان الموافقة على أول علاج جيني بتقنية CRISPR لفقر الدم المنجلي. - MedlinePlus – National Library of Medicine. What is a gene mutation?
https://medlineplus.gov/genetics/understanding/mutationsanddisorders/genemutation/
شرح مبسط وموثق لأنواع الطفرات الجينية من المكتبة الوطنية الأمريكية للطب. - Saudi Premarital Screening Program – Ministry of Health, Saudi Arabia.
https://www.moh.gov.sa/en/HealthAwareness/Beforemarriage/Pages/default.aspx
صفحة وزارة الصحة السعودية لبرنامج الفحص قبل الزواج.
الكتب والموسوعات العلمية
- Griffiths, A. J. F., Wessler, S. R., Carroll, S. B., & Doebley, J. (2020). Introduction to Genetic Analysis (12th ed.). W.H. Freeman.
كتاب مرجعي شامل في علم الوراثة يُستخدم في الجامعات العالمية. - Strachan, T., & Read, A. P. (2019). Human Molecular Genetics (5th ed.). Garland Science.
من أهم المراجع في الوراثة الجزيئية البشرية والأمراض الوراثية. - Alberts, B., Johnson, A., Lewis, J., et al. (2022). Molecular Biology of the Cell (7th ed.). W.W. Norton & Company.
الكتاب المرجعي الأشهر في البيولوجيا الجزيئية، يشرح آليات إصلاح DNA بتفصيل.
مقالات علمية مبسطة
- Comfort, N. (2019). How science has shifted our sense of identity. Nature, 574, 167-170.
https://doi.org/10.1038/d41586-019-03014-4
مقال يناقش كيف غيّر فهمنا للجينات والطفرات نظرتنا لهويتنا البيولوجية.
قراءات إضافية ومصادر للتوسع
- Krebs, J. E., Goldstein, E. S., & Kilpatrick, S. T. (2021). Lewin’s Genes XII (12th ed.). Jones & Bartlett Learning.
لماذا نقترح عليك قراءته؟ هذا الكتاب يُعَدُّ من أعمق المراجع في شرح تنظيم الجينات وتأثير الطفرات على التعبير الجيني، مع أمثلة سريرية حديثة. - Nussbaum, R. L., McInnes, R. R., & Willard, H. F. (2021). Thompson & Thompson Genetics in Medicine (9th ed.). Elsevier.
لماذا نقترح عليك قراءته؟ إذا كنت طالب طب أو علوم صحية، فهذا الكتاب يربط بين علم الوراثة والممارسة الطبية السريرية بطريقة ممتازة، مع فصول مخصصة للاستشارة الوراثية. - Doudna, J. A., & Sternberg, S. H. (2017). A Crack in Creation: Gene Editing and the Unthinkable Power to Control Evolution. Houghton Mifflin Harcourt.
لماذا نقترح عليك قراءته؟ كتاب غير تقني كتبته مخترعة CRISPR نفسها. يشرح التقنية والأبعاد الأخلاقية بأسلوب سردي شيق يناسب غير المتخصصين.
📑 بروتوكولات ودلائل إرشادية رسمية ذات صلة
- الكلية الأمريكية لعلم الوراثة الطبية والجينوميات (ACMG) — دلائل إرشادية لتصنيف الطفرات الجينية وتفسير المتغيرات الوراثية (ACMG/AMP Guidelines 2015، مُحدّثة 2024).
- منظمة الصحة العالمية (WHO) — تقرير الجينوميات وصحة السكان: إطار عمل لتعزيز الخدمات الوراثية (2024).
- وزارة الصحة السعودية — بروتوكول برنامج الفحص قبل الزواج الإلزامي للكشف عن فقر الدم المنجلي والثلاسيميا.
- الجمعية الأوروبية لعلم الوراثة البشرية (ESHG) — توصيات حول الفحص الجيني وأخلاقيات التعديل الوراثي (2023).
- هيئة الغذاء والدواء الأمريكية (FDA) — الموافقة على علاج Casgevy بتقنية CRISPR لفقر الدم المنجلي والثلاسيميا بيتا (ديسمبر 2023).
✅ بيان المصداقية
تلتزم موسوعة خلية العلمية بتقديم محتوى علمي دقيق وموثوق ومبني على أحدث الأدلة والأبحاث المنشورة في دوريات علمية محكّمة. يتم الاستشهاد بمصادر موثوقة تشمل المعاهد الوطنية للصحة (NIH)، ومنظمة الصحة العالمية (WHO)، ومراكز بحثية وأكاديمية معتمدة دولياً. يخضع كل مقال لمراجعة علمية من قبل هيئة التحرير العلمية لضمان صحة المعلومات وحداثتها. نحن نؤمن بأن المعرفة العلمية الصحيحة حق للجميع، ونسعى إلى تقديمها بلغة عربية واضحة دون الإخلال بالدقة العلمية.
⚠️ تحذير وإخلاء مسؤولية
المعلومات الواردة في هذا المقال مقدمة من موسوعة خلية العلمية لأغراض تثقيفية وتعليمية فقط، ولا تُعَدُّ بديلاً عن الاستشارة الطبية المتخصصة أو التشخيص أو العلاج. لا ينبغي الاعتماد على محتوى هذا المقال لاتخاذ قرارات صحية تتعلق بالأمراض الوراثية أو الفحوصات الجينية دون الرجوع إلى طبيب وراثة أو أخصائي معتمد. تختلف الحالات الفردية وقد لا تنطبق المعلومات العامة المذكورة على وضعك الخاص. موسوعة خلية العلمية غير مسؤولة عن أي ضرر مباشر أو غير مباشر ينتج عن استخدام المعلومات الواردة في هذا المحتوى.
📋 جرت مراجعة هذه المقالة
جرت مراجعة هذا المقال من قبل هيئة التحرير العلمية في موسوعة خلية العلمية لضمان الدقة العلمية وجودة المحتوى.
آخر تحديث: يناير 2026
إذا كانت لديك ملاحظات أو استفسارات حول محتوى هذا المقال، يمكنك التواصل معنا عبر صفحة التواصل.