الجدول الدوري للعناصر الكيميائية: كيف تفهمه وتحفظه بسهولة؟
ما سر ترتيب العناصر وكيف تستفيد منه في دراستك وحياتك اليومية؟
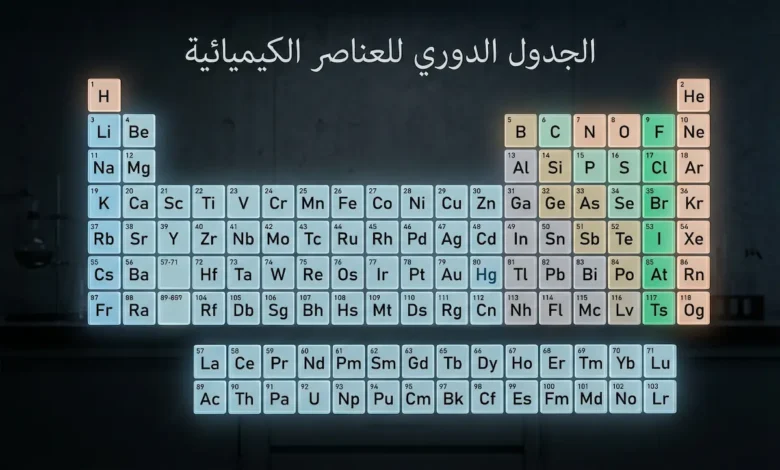
الجدول الدوري للعناصر هو تنظيم منهجي للعناصر الكيميائية المعروفة وفق أعدادها الذرية المتصاعدة، ويضم 118 عنصراً مرتبة في 7 دورات أفقية و18 مجموعة رأسية. يُظهر هذا الترتيب تكرار الخصائص الكيميائية والفيزيائية بشكل دوري؛ إذ تتشابه العناصر الواقعة في المجموعة الواحدة في سلوكها الكيميائي. يُعَدُّ هذا الجدول الأداة الأساسية لفهم الكيمياء والتنبؤ بتفاعلات المواد.
هل وقفت يوماً أمام الجدول الدوري للعناصر في صفك الدراسي وشعرت بأنه لوحة معقدة مليئة بالرموز الغامضة؟ أنت لست وحدك في هذا الشعور. كثير من الطلاب يعانون من صعوبة فهم منطق ترتيب العناصر، ويجدون أنفسهم يحفظون دون استيعاب حقيقي. لكن ماذا لو أخبرتك أن هذا الجدول ليس سوى خريطة منظمة تكشف لك أسرار المادة من حولك؟ في هذا المقال ستجد شرحاً مبسطاً يحول هذه الخريطة من لغز محيّر إلى أداة تفهمها وتستخدمها بثقة، بل وستتعلم طرقاً ذكية لحفظها دون عناء.
كيف بدأت قصة ترتيب العناصر الكيميائية؟

لم يكن الوصول إلى الجدول الدوري للعناصر بالشكل الذي نعرفه اليوم أمراً سهلاً أو مفاجئاً. لقد استغرق الأمر قروناً من المحاولات والإخفاقات قبل أن يتمكن العلماء من اكتشاف النمط الخفي الذي يربط بين العناصر المختلفة.
في القرن التاسع عشر، كان العلماء يعرفون نحو 60 عنصراً فقط، وكانت الفوضى تسود محاولات تصنيفها. فقد حاول الكيميائي الألماني يوهان دوبراينر (Johann Döbereiner) عام 1829 تجميع العناصر في ثلاثيات بناءً على تشابه خصائصها، لكن هذا النظام لم يشمل جميع العناصر المعروفة آنذاك. بعده جاء الإنكليزي جون نيولاندز (John Newlands) عام 1866 بقانون الثمانيات؛ إذ لاحظ أن الخصائص تتكرر كل ثمانية عناصر، غير أن زملاءه سخروا من فكرته ولم تلقَ قبولاً.
حقيقة مدهشة
عندما عرض نيولاندز قانون الثمانيات أمام الجمعية الكيميائية البريطانية، سأله أحد الحاضرين ساخراً: “هل حاولت ترتيب العناصر أبجدياً؟” — لم يأخذه أحد على محمل الجد حينها!
ثم جاء العالم الروسي ديمتري مندليف (Dmitri Mendeleev) عام 1869 ليغير مسار تاريخ علم الكيمياء. لقد رتب العناصر حسب كتلتها الذرية المتصاعدة، لكن عبقريته الحقيقية تجلت في شيء آخر. عندما وجد أن بعض العناصر لا تتناسب مع النمط المتوقع، لم يتجاهل المشكلة بل ترك فراغات في جدوله وتنبأ بجرأة بوجود عناصر لم تُكتشف بعد. وقد وصف خصائص هذه العناصر المجهولة بدقة مذهلة، مثل “إيكا-ألومنيوم” الذي اكتُشف لاحقاً باسم الغاليوم (Gallium) عام 1875، و”إيكا-سيليكون” الذي عُرف باسم الجرمانيوم (Germanium) عام 1886. هذه التنبؤات الناجحة أثبتت صحة نظريته وأكسبته لقب “أبو الجدول الدوري”.
لكن الجدول لم يكتمل بعد. ففي عام 1913، أجرى الفيزيائي البريطاني هنري موزلي (Henry Moseley) تجارب على الأشعة السينية واكتشف أن الخاصية الجوهرية التي تحدد هوية العنصر الكيميائي ليست كتلته بل عدده الذري (Atomic Number)؛ أي عدد البروتونات في نواته. وعليه فإن إعادة ترتيب العناصر وفق العدد الذري حلّت بعض التناقضات التي واجهها مندليف، وأصبح هذا المعيار هو الأساس في الجدول الدوري الحديث الذي نستخدمه اليوم.
اقرأ أيضاً:
- جابر بن حيان: مؤسس علم الكيمياء
- علم الخيمياء (Alchemy): الأصول، الأهداف، والإرث
- تحويل الرصاص إلى ذهب: الكيمياء، الفيزياء، ومحاولات الخيميائيين
كيف تقرأ الجدول الدوري للعناصر بشكل صحيح؟
قبل أن تغوص في تفاصيل العناصر وعائلاتها، عليك أولاً أن تفهم البنية الأساسية للجدول الدوري للعناصر وكيفية قراءة المعلومات المعروضة فيه. تخيل أنك تتعلم قراءة خريطة جديدة — بمجرد أن تفهم الرموز والمفاتيح، يصبح التنقل فيها سهلاً.
ما الذي يحتويه “مربع العنصر”؟

كل عنصر في الجدول يُمثَّل بمربع صغير يحتوي على معلومات أساسية مكثفة. في مركز المربع تجد الرمز الكيميائي (Chemical Symbol) المكون من حرف أو حرفين لاتينيين، مثل H للهيدروجين وFe للحديد وAu للذهب. الجدير بالذكر أن بعض الرموز مشتقة من الأسماء اللاتينية القديمة؛ فالحديد رمزه Fe من “Ferrum” والذهب رمزه Au من “Aurum”.
فوق الرمز يظهر العدد الذري (Atomic Number) الذي يمثل عدد البروتونات في نواة الذرة، وهو الرقم الذي يحدد هوية العنصر ولا يتكرر بين عنصرين مختلفين. أما أسفل الرمز فتجد الكتلة الذرية (Atomic Mass) التي تعبر عن متوسط كتل النظائر الطبيعية للعنصر، وتُقاس بوحدة الكتل الذرية (amu). في بعض الجداول الحديثة تجد أيضاً اسم العنصر الكامل والتوزيع الإلكتروني.
مستكشف العناصر الكيميائية
اختر عنصراً لمعرفة معلوماته الأساسية
ما الفرق بين الدورات والمجموعات؟
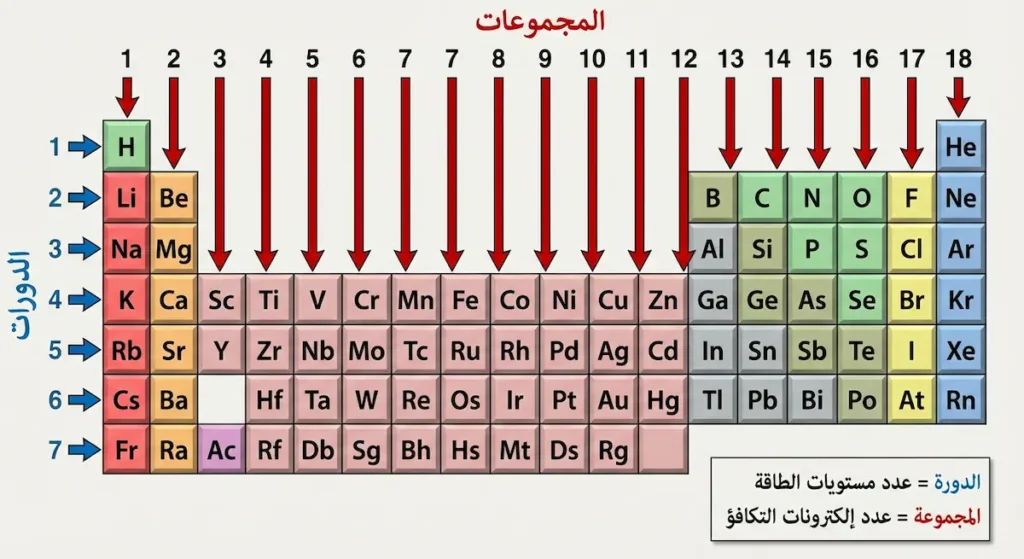
الصفوف الأفقية تُسمى الدورات (Periods) وعددها سبع دورات، وهي تمثل مستويات الطاقة الإلكترونية. كلما انتقلت إلى دورة أدنى، أُضيف مستوى طاقة جديد للذرات. فذرات الدورة الأولى تملك مستوى طاقة واحداً، بينما ذرات الدورة السابعة تملك سبعة مستويات.
الأعمدة الرأسية تُسمى المجموعات (Groups) وعددها 18 مجموعة، وهنا يكمن السر العظيم للجدول الدوري. العناصر في المجموعة الواحدة تتشابه في عدد إلكترونات التكافؤ (Valence Electrons)؛ أي الإلكترونات الموجودة في المستوى الخارجي والمسؤولة عن السلوك الكيميائي. وبالتالي فإن العناصر في المجموعة ذاتها تتصرف بطريقة متشابهة في التفاعلات الكيميائية، وهذا ما يجعل الجدول أداة تنبؤية قوية.
| وجه المقارنة | الدورة (Period) | المجموعة (Group) |
|---|---|---|
| الاتجاه | صف أفقي | عمود رأسي |
| العدد في الجدول | 7 دورات | 18 مجموعة |
| ما تمثله | عدد مستويات الطاقة (الأغلفة الإلكترونية) | عدد إلكترونات التكافؤ |
| التشابه بين العناصر | تتشابه في عدد الأغلفة فقط | تتشابه في السلوك الكيميائي |
| تغير العدد الذري | يزداد من اليسار لليمين | يزداد من الأعلى للأسفل |
| تغير نصف القطر الذري | يقل من اليسار لليمين | يزداد من الأعلى للأسفل |
| تغير طاقة التأين | تزداد من اليسار لليمين | تقل من الأعلى للأسفل |
| تغير السالبية الكهربية | تزداد من اليسار لليمين | تقل من الأعلى للأسفل |
| التطبيق العملي | تحديد حجم الذرة ومستوى طاقتها | التنبؤ بالتفاعلات الكيميائية |
| مثال | الدورة 3: من Na إلى Ar | المجموعة 1: Li, Na, K, Rb, Cs, Fr |
| المصدر: الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) | ||
حاسبة إلكترونات التكافؤ
اختر المجموعة لمعرفة عدد إلكترونات التكافؤ
معلومة سريعة
عناصر المجموعة الأولى (الفلزات القلوية) جميعها شديدة التفاعل مع الماء وتُنتج غاز الهيدروجين وتُطلق حرارة كبيرة — لذلك تُحفظ في الزيت وليس في الماء!
ما هي الفئات في الجدول الدوري؟
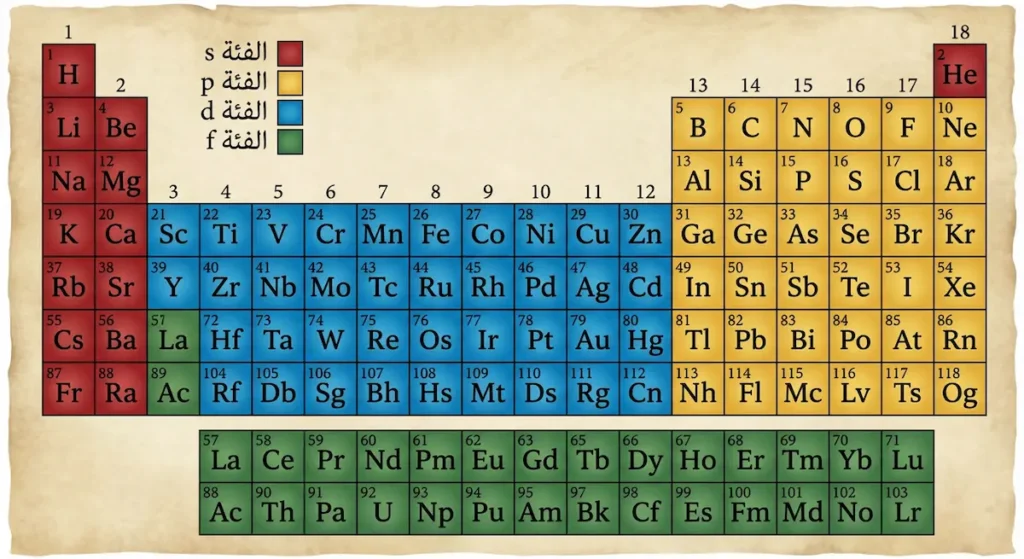
قسّم العلماء العناصر إلى أربع فئات رئيسة (Blocks) بناءً على المدار الذري الذي يُملأ بالإلكترونات:
الفئة s تضم المجموعتين الأولى والثانية إضافةً إلى الهيليوم، وتتميز بأن إلكتروناتها الأخيرة تشغل المدار s. الفئة p تشمل المجموعات من 13 إلى 18، وتضم اللافلزات ومعظم أشباه الفلزات. الفئة d تحتوي على الفلزات الانتقالية الموجودة في وسط الجدول (المجموعات 3-12). أما الفئة f فتضم اللانثانيدات والأكتينيدات، وهي السلسلتان المفصولتان أسفل الجدول — وفصلهما ليس إلا لأسباب تنسيقية كي لا يصبح الجدول عريضاً جداً.
ما هي عائلات العناصر في الجدول الدوري؟
لفهم الجدول الدوري للعناصر بعمق، يجب أن تتعرف على "العائلات" الكبرى التي تجمع العناصر ذات الخصائص المتشابهة. تخيل هذه العائلات كأحياء مختلفة في مدينة واحدة، لكل حي طابعه وسكانه المميزون.
مُحدد عائلة العنصر
أدخل رمز العنصر لمعرفة عائلته وخصائصها
الفلزات القلوية والقلوية الترابية: العناصر النشطة جداً

المجموعة الأولى (Group 1) تضم الفلزات القلوية (Alkali Metals): الليثيوم (Li)، الصوديوم (Na)، البوتاسيوم (K)، الروبيديوم (Rb)، السيزيوم (Cs)، والفرانسيوم (Fr). هذه العناصر طرية يمكن قطعها بالسكين، ولامعة عند قطعها حديثاً لكنها تفقد بريقها سريعاً عند تعرضها للهواء؛ لأنها تتفاعل مع الأكسجين والرطوبة بسهولة.
كلما نزلت في المجموعة زادت شدة التفاعل. فالصوديوم يتفاعل مع الماء بقوة مُنتجاً فرقعات وحرارة، بينما السيزيوم ينفجر بعنف عند ملامسته للماء. هذا السلوك المتدرج مثال عملي على "الدورية" التي يُظهرها الجدول. أما الفرانسيوم فهو أندر عنصر طبيعي على الأرض؛ إذ لا يوجد منه في أي لحظة أكثر من 30 غراماً تقريباً على كوكبنا بأكمله!
المجموعة الثانية (Group 2) تحتوي على الفلزات القلوية الترابية (Alkaline Earth Metals): البيريليوم (Be)، المغنيسيوم (Mg)، الكالسيوم (Ca)، السترونشيوم (Sr)، الباريوم (Ba)، والراديوم (Ra). هذه العناصر أقل نشاطاً من القلوية لكنها لا تزال تفاعلية. المغنيسيوم يُستخدم في صناعة سبائك الطائرات لخفته، والكالسيوم ضروري لصحة العظام والأسنان.
الفلزات الانتقالية: عماد الصناعة الحديثة

تشغل الفلزات الانتقالية (Transition Metals) المنطقة الوسطى من الجدول الدوري للعناصر، وتُشكّل الفئة d. تتميز بكثافتها العالية وصلابتها ونقاط انصهارها المرتفعة، وهي العمود الفقري للصناعة الحديثة. الحديد (Fe) يدخل في صناعة الفولاذ والبناء والسيارات. النحاس (Cu) موصل ممتاز للكهرباء ويُستخدم في الأسلاك الكهربائية. الذهب (Au) والفضة (Ag) والبلاتين (Pt) معادن ثمينة تُستخدم في الحلي والإلكترونيات الدقيقة.
من السمات المميزة للفلزات الانتقالية قدرتها على تكوين مركبات ملونة متعددة. فمركبات النحاس زرقاء أو خضراء، ومركبات الحديد حمراء أو صفراء أو بنية، ومركبات الكوبالت زرقاء زاهية. هذه الألوان ناتجة عن امتصاص الضوء بأطوال موجية معينة بسبب انتقالات الإلكترونات في المدارات d.
هل تعلم؟
التيتانيوم (Ti) أقوى من الفولاذ بنسبة 45% لكنه أخف منه بنسبة 40%، لذلك يُستخدم في صناعة هياكل الطائرات المقاتلة والمركبات الفضائية والمفاصل الصناعية الطبية.
أشباه الفلزات: كيف غيّر السيليكون عالم الإلكترونيات؟

أشباه الفلزات (Metalloids) تقع على الخط الفاصل بين الفلزات واللافلزات في الجدول، وتجمع بين خصائص النوعين. أهمها السيليكون (Si) والجرمانيوم (Ge) اللذان يُعَدَّان أساس صناعة أشباه الموصلات (Semiconductors).
قصة السيليكون مذهلة حقاً. هذا العنصر الذي يُشكّل نحو 28% من قشرة الأرض — وهو ثاني أكثر العناصر وفرة فيها بعد الأكسجين — أصبح حجر الأساس للثورة الرقمية. الرقائق الإلكترونية في هاتفك وحاسوبك والخوادم التي تخزن بياناتك كلها مصنوعة من السيليكون. وليس من قبيل الصدفة أن تُسمى منطقة التقنية العالية في كاليفورنيا "وادي السيليكون" (Silicon Valley).
ما يجعل السيليكون مميزاً هو قدرته على التحكم في التوصيل الكهربائي. في حالته النقية هو موصل ضعيف، لكن عند إضافة شوائب محددة (عملية تُسمى التشويب أو Doping) يمكن جعله موصلاً أو عازلاً حسب الحاجة. هذه الخاصية هي أساس عمل الترانزستورات التي تُشكّل الوحدات البنائية لجميع الدوائر الإلكترونية.
اللافلزات والغازات النبيلة

اللافلزات (Non-metals) تشغل الجانب الأيمن العلوي من الجدول الدوري للعناصر، وتشمل عناصر حيوية مثل الكربون (C) والنيتروجين (N) والأكسجين (O) والكبريت (S) والفوسفور (P). هذه العناصر هي اللبنات الأساسية للحياة؛ فالكربون يُشكّل هيكل جميع المركبات العضوية، والأكسجين ضروري للتنفس، والنيتروجين مكون رئيس للبروتينات.
تختلف اللافلزات عن الفلزات في كونها رديئة التوصيل للحرارة والكهرباء، وهشة عندما تكون صلبة، ولها نقاط انصهار وغليان منخفضة عموماً. كيميائياً، تميل إلى اكتساب الإلكترونات في التفاعلات بدلاً من فقدانها.
الغازات النبيلة (Noble Gases) — الهيليوم (He)، النيون (Ne)، الأرغون (Ar)، الكريبتون (Kr)، الزينون (Xe)، والرادون (Rn) — تحتل المجموعة 18 وهي آخر عمود على اليمين. سُميت "نبيلة" لأنها لا تتفاعل تقريباً مع العناصر الأخرى، فهي مستقرة تماماً لأن غلافها الإلكتروني الخارجي مكتمل. هذا الاستقرار يجعلها مثالية لتطبيقات تتطلب بيئة خاملة، كملء المصابيح الكهربائية والإشارات الضوئية الملونة.

حقيقة علمية
كان العلماء يعتقدون أن الغازات النبيلة لا تُكوّن أي مركبات إطلاقاً، حتى عام 1962 عندما نجح الكيميائي نيل بارتليت (Neil Bartlett) في تحضير أول مركب للزينون، مُحطماً بذلك اعتقاداً علمياً استمر عقوداً.
اقرأ أيضاً:
- عناصر الهالوجين: الخصائص، المركبات، والتطبيقات
- الروابط الكيميائية: الأنواع، التكوين، والخصائص
- الجزيء (Molecule): التركيب، الترابط، والأنواع
كيف يُدرَّس الجدول الدوري للعناصر في العالم العربي؟
للعرب والمسلمين إسهامات عظيمة في تأسيس علم الكيمياء قبل قرون من ظهور الجدول الدوري الحديث. جابر بن حيان (721-815م) الملقب بـ"أبو الكيمياء" طوّر تقنيات التقطير والتبلور وصنع الأحماض القوية كحمض الكبريتيك وحمض النيتريك. الرازي (854-925م) صنّف المواد إلى حيوانية ونباتية ومعدنية، وهو تصنيف مبكر سبق التصنيفات الحديثة. هؤلاء العلماء وضعوا اللبنات التي بنى عليها الكيميائيون اللاحقون.
في واقعنا العربي المعاصر، يُدرَّس الجدول الدوري للعناصر ضمن مناهج الكيمياء ابتداءً من المرحلة الإعدادية في معظم الدول العربية. لكن التحدي الذي يواجهه كثير من الطلاب هو أسلوب التلقين دون الفهم. المعلم المتميز يربط الجدول بالحياة اليومية: لماذا الصوديوم في ملح الطعام؟ لماذا الكلور في مياه المسبح؟ لماذا الحديد يصدأ والذهب لا يصدأ؟
العالم العربي غني بالموارد المعدنية المرتبطة بالجدول الدوري. الفوسفات — وهو مركب الفوسفور — يُستخرج بكميات ضخمة من المغرب والأردن وتونس ومصر؛ إذ يمتلك المغرب وحده نحو 70% من احتياطيات الفوسفات العالمية. النفط والغاز في الخليج العربي مركبات كربونية (هيدروكربونات). الذهب يُستخرج من مناجم السعودية ومصر والسودان. هذا الربط بين الجدول الدوري والثروات الطبيعية يجعل تعلمه أكثر إثارة وأهمية.
أين تجد عناصر الجدول الدوري في منزلك؟

قد تظن أن العناصر الكيميائية موجودة فقط في المختبرات، لكن الحقيقة أنك محاط بها في كل لحظة. انظر حولك الآن — كل شيء تراه وتلمسه مكون من عناصر الجدول الدوري للعناصر.
هاتفك الذكي كنز من العناصر. شاشته تحتوي على الإنديوم (In) والقصدير (Sn) في طبقة الـITO الموصلة الشفافة. بطاريته ليثيوم-أيون تعتمد على الليثيوم (Li) والكوبالت (Co). معالجه مصنوع من السيليكون (Si). لونه الفضي أو الذهبي يأتي من طلاء الألومنيوم (Al) أو سبائك أخرى. المغناطيس الصغير في مكبر الصوت يحتوي على النيوديميوم (Nd) وهو من العناصر الأرضية النادرة. الدوائر الإلكترونية تضم الذهب (Au) والفضة (Ag) والنحاس (Cu) كموصلات. باختصار، هاتفك يحتوي على أكثر من 30 عنصراً مختلفاً!
في مطبخك، القدور والمقالي مصنوعة من الحديد (Fe) أو الألومنيوم أو النحاس أو الفولاذ المقاوم للصدأ (الذي يحتوي على الحديد والكروم والنيكل). ملح الطعام هو كلوريد الصوديوم (NaCl). صودا الخبز هي بيكربونات الصوديوم (NaHCO₃). ورق الألمنيوم للتغليف. الثلاجة تستخدم غازات تبريد متعددة.
في حمامك، الكلور (Cl) في المبيضات ومواد التنظيف. الفلور (F) في معجون الأسنان لحماية الأسنان من التسوس. اليود (I) في المطهرات.
معلومة قيّمة
جسم الإنسان البالغ يحتوي على نحو 60% أكسجين، و18% كربون، و10% هيدروجين، و3% نيتروجين، إضافة إلى كميات صغيرة من الكالسيوم والفوسفور والبوتاسيوم والكبريت والصوديوم والمغنيسيوم وعناصر أخرى — أنت نفسك جدول دوري متحرك!
مثال تطبيقي: كيف تتوقع خصائص عنصر لم تدرسه؟
لنفترض أنك طالب في امتحان الكيمياء، وسألك المعلم عن خصائص عنصر السترونشيوم (Sr) الذي لم تدرسه بالتفصيل. كيف ستجيب؟
أولاً، ابحث عن موقعه في الجدول الدوري للعناصر. ستجده في المجموعة الثانية (الفلزات القلوية الترابية) والدورة الخامسة. الآن انظر إلى العناصر الأخرى في نفس المجموعة: البيريليوم، المغنيسيوم، الكالسيوم، الباريوم. أنت تعرف أن الكالسيوم والمغنيسيوم فلزات لامعة تتفاعل مع الماء (وإن كان تفاعلها أقل من الفلزات القلوية) وتكوّن أكاسيد قاعدية.
إذاً يمكنك أن تستنتج بثقة أن السترونشيوم: (1) فلز صلب لامع، (2) يتفاعل مع الماء بشدة متوسطة، (3) يكوّن أيونات ثنائية الشحنة الموجبة (Sr²⁺)، (4) يكوّن أكسيداً قاعدياً (SrO). وبما أنه أسفل الكالسيوم وأعلى الباريوم، فإن تفاعليته تقع بينهما. هذا هو بالضبط ما يفعله العلماء: يستخدمون النمط الدوري للتنبؤ بخصائص عناصر لم يدرسوها بالتفصيل.
كيف تحفظ الجدول الدوري للعناصر بسهولة؟

هذا القسم هو ما يبحث عنه آلاف الطلاب. الحقيقة أن حفظ الجدول الدوري للعناصر بالكامل ليس ضرورياً للجميع، لكن حفظ المجموعات الرئيسة مفيد جداً لفهم الكيمياء وحل المسائل.
طريقة الجمل المضحكة (Mnemonics)
الدماغ البشري يحفظ القصص والجمل الغريبة أفضل بكثير من القوائم الجافة. إليك بعض الجمل العربية لحفظ أشهر المجموعات:
المجموعة الأولى (الفلزات القلوية): H, Li, Na, K, Rb, Cs, Fr
الجملة: "هَلْ لِي نَاقةٌ كَريمة رَبِّي سَيُفَرِّحُها"
(هـ = هيدروجين، لي = ليثيوم، نا = صوديوم، ك = بوتاسيوم، ربـ = روبيديوم، سـ = سيزيوم، فر = فرانسيوم)
المجموعة الثانية (القلوية الترابية): Be, Mg, Ca, Sr, Ba, Ra
الجملة: "بِمَ كَسَرْتَ بابَ رامي؟"
المجموعة السابعة عشرة (الهالوجينات): F, Cl, Br, I, At
الجملة: "فَكُلْ بِراحة أَنْتَ ضيف"
طريقة التقسيم والتكرار المتباعد
لا تحاول حفظ الجدول كاملاً دفعة واحدة. قسّمه إلى أجزاء صغيرة:
- الأسبوع الأول: المجموعتين 1 و2
- الأسبوع الثاني: المجموعات 13-18
- الأسبوع الثالث: الفلزات الانتقالية الأكثر شيوعاً
استخدم تقنية التكرار المتباعد (Spaced Repetition): راجع ما حفظته بعد يوم، ثم بعد 3 أيام، ثم بعد أسبوع، ثم بعد أسبوعين. هذه الطريقة أثبتت فعاليتها علمياً في تثبيت المعلومات في الذاكرة طويلة الأمد.
طريقة الربط البصري
علّق نسخة كبيرة من الجدول الدوري في غرفتك بحيث تراها يومياً. استخدم الألوان للتمييز بين الفئات المختلفة. بعض الطلاب يصنعون بطاقات تعليمية (Flashcards) لكل عنصر. تطبيقات الهاتف مثل "Periodic Table Quiz" تساعد في التدريب بشكل تفاعلي.
نصيحة ذهبية
لا تحفظ الرموز فقط بل اربطها بالاستخدامات. عندما تتذكر أن Fe هو الحديد، تخيل مباشرةً الجسور والسيارات والمباني الحديدية. هذا الربط يجعل الحفظ أسهل والاسترجاع أسرع.
ما هي العناصر المكتشفة حديثاً في الجدول الدوري؟

الجدول الدوري للعناصر ليس ثابتاً بل يتوسع مع كل اكتشاف جديد. آخر أربعة عناصر أُضيفت رسمياً كانت عام 2016 بعد اعتراف الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC):
- نيهونيوم (Nihonium - Nh) العدد الذري 113، سُمي تكريماً لليابان (نيهون باليابانية)
- موسكوفيوم (Moscovium - Mc) العدد الذري 115، نسبةً إلى موسكو
- تينيسين (Tennessine - Ts) العدد الذري 117، نسبةً إلى ولاية تينيسي الأمريكية
- أوغانيسون (Oganesson - Og) العدد الذري 118، تكريماً للعالم الروسي يوري أوغانيسيان
هذه العناصر فائقة الثقل (Superheavy Elements) لا توجد طبيعياً بل تُصنَّع في المختبرات عبر تصادم نوى ذرية بسرعات هائلة. عمرها قصير جداً؛ بعضها يتحلل خلال أجزاء من الثانية، مما يجعل دراسة خصائصها تحدياً كبيراً. يعمل العلماء حالياً على محاولة تخليق العنصر 119 و120، لكن هذا يتطلب تقنيات متقدمة جداً ومسرعات جسيمات عملاقة.
رقم صادم
العنصر 118 (أوغانيسون) يتحلل خلال 0.89 ميلي ثانية فقط — أي أقل من واحد على ألف من الثانية! لذلك كل ما نعرفه عنه يأتي من عدد قليل جداً من الذرات التي تمكن العلماء من رصدها قبل اختفائها.
ما أهمية الجدول الدوري للعناصر في حياتنا اليومية؟
قد يبدو الجدول الدوري للعناصر أداة أكاديمية بحتة، لكنه في الواقع يؤثر في كل جانب من حياتنا الحديثة. الصناعات الدوائية تستخدمه لتصميم الأدوية؛ فمعرفة خصائص العناصر تساعد في فهم كيف تتفاعل المركبات مع الجسم. صناعة السيارات تعتمد على سبائك معينة من الفلزات لتحقيق التوازن بين القوة والخفة. الطاقة المتجددة ترتكز على عناصر مثل السيليكون في الألواح الشمسية والليثيوم في البطاريات القابلة للشحن.
في الطب، النظائر المشعة (Radioactive Isotopes) لعناصر معينة تُستخدم في التشخيص والعلاج. اليود-131 يُعالج أمراض الغدة الدرقية. التكنيشيوم-99m يُستخدم في ملايين الفحوصات التصويرية سنوياً. البلاتين مكون أساسي في أدوية السرطان مثل السيسبلاتين.
في الزراعة، النيتروجين والفوسفور والبوتاسيوم (N-P-K) هي العناصر الثلاثة الرئيسة في الأسمدة، وفهم خصائصها الكيميائية يساعد في تحسين إنتاجية المحاصيل.
في التقنية المتقدمة، العناصر الأرضية النادرة (Rare Earth Elements) مثل النيوديميوم والسماريوم والديسبروسيوم ضرورية لصناعة المغناطيسات القوية في محركات السيارات الكهربائية وتوربينات الرياح. الجرمانيوم والغاليوم يُستخدمان في أشباه الموصلات المتقدمة. الإنديوم والتيلوريوم في الخلايا الشمسية.
اقرأ أيضاً:
- علم الأدوية (Pharmacology): دراسة تفاعل الأدوية مع الكائن الحي
- الزراعة الحديثة: التقنيات، التحديات، ومستقبل الأمن الغذائي
- النانوتكنولوجيا (Nanotechnology): المفهوم، التطبيقات، والمستقبل
ما الفرق بين الدورة والمجموعة في الجدول الدوري؟
سؤال يتكرر كثيراً بين الطلاب، والإجابة الواضحة تُزيل كثيراً من الالتباس.
الدورة (Period) هي الصف الأفقي، وتدل على عدد مستويات الطاقة (الأغلفة الإلكترونية) في ذرات العناصر الواقعة فيها. عناصر الدورة الثالثة مثلاً — من الصوديوم إلى الأرغون — جميعها تملك ثلاثة مستويات طاقة. كلما انتقلت من اليسار إلى اليمين في الدورة الواحدة، يزداد العدد الذري، ويزداد عدد الإلكترونات، ويصغر حجم الذرة (بسبب زيادة قوة جذب النواة للإلكترونات)، وتزداد طاقة التأين، وتزداد السالبية الكهربية.
المجموعة (Group) هي العمود الرأسي، وتدل على عدد إلكترونات التكافؤ. عناصر المجموعة الواحدة تتشابه في سلوكها الكيميائي لأنها تملك نفس عدد الإلكترونات في غلافها الخارجي. مثلاً، جميع عناصر المجموعة 17 (الهالوجينات) تملك 7 إلكترونات تكافؤ، لذلك جميعها تميل إلى اكتساب إلكترون واحد لتصل إلى الاستقرار، مما يجعلها شديدة التفاعل والأكسدة.

ما العناصر الأكثر وفرة والأندر في الكون والأرض؟
في الكون ككل، الهيدروجين هو العنصر الأكثر وفرة بنسبة تتجاوز 73%، يليه الهيليوم بنسبة نحو 25%. هذان العنصران يُشكّلان معاً أكثر من 98% من المادة العادية في الكون. العناصر الأثقل — التي تُسمى "الفلزات" في المصطلح الفلكي — لا تُشكّل سوى 2% فقط، وقد تكونت داخل النجوم عبر الاندماج النووي أو في انفجارات المستعرات العظمى (Supernovae).

أما على الأرض فالوضع مختلف. الأكسجين هو الأكثر وفرة في القشرة الأرضية بنسبة نحو 46%، يليه السيليكون بنسبة 28%، ثم الألومنيوم والحديد. في الغلاف الجوي، النيتروجين يُشكّل 78% والأكسجين 21%. في المحيطات، الأكسجين والهيدروجين (مكونا الماء) هما الأكثر وفرة.
أما الأندر طبيعياً فهو الأستاتين (At) والفرانسيوم (Fr). الأستاتين نادر لدرجة أنه لا يوجد منه أكثر من غرام واحد في القشرة الأرضية بأكملها في أي لحظة، لأنه يتحلل بسرعة كبيرة. الفرانسيوم أيضاً يتحلل خلال دقائق.
لماذا توجد سلسلتان منفصلتان أسفل الجدول الدوري؟

ينتبه كثير من الناظرين إلى الجدول الدوري للعناصر إلى وجود صفين منفصلين في الأسفل، وقد يتساءلون عن السبب. هذان الصفان هما اللانثانيدات (Lanthanides) والأكتينيدات (Actinides)، وهما ينتميان في الحقيقة إلى الدورتين السادسة والسابعة على التوالي.
السبب في فصلهما تنسيقي بحت. لو وُضعت هذه العناصر في مكانها الحقيقي داخل الجدول، لأصبح الجدول عريضاً جداً (32 عموداً بدلاً من 18)، مما يجعله صعب القراءة والطباعة. لذلك اتُّفق على إخراجها ووضعها أسفل الجدول مع إشارة تدل على موقعها الأصلي.
اللانثانيدات (العناصر من 57 إلى 71) تُسمى أيضاً "العناصر الأرضية النادرة" رغم أن بعضها ليس نادراً فعلياً. لها تطبيقات مهمة في المغناطيسات القوية والليزر والمصابيح الفلورية. الأكتينيدات (العناصر من 89 إلى 103) تضم عناصر مشعة مثل اليورانيوم والبلوتونيوم المستخدمين في الطاقة النووية.
كم عدد العناصر في الجدول الدوري حتى الآن؟
حتى عام 2025، يحتوي الجدول الدوري للعناصر على 118 عنصراً معترفاً بها رسمياً من قِبَل IUPAC. من هذه العناصر، 94 عنصراً توجد طبيعياً على الأرض (بما فيها بعض العناصر المشعة النادرة)، و24 عنصراً اصطناعية صُنعت في المختبرات.
لكن هل ينتهي الجدول عند 118؟ نظرياً لا. العلماء يحاولون تخليق عناصر أثقل، لكن التحدي يكمن في أن هذه العناصر تصبح أقل استقراراً كلما زاد عددها الذري. هناك نظرية تُسمى "جزيرة الاستقرار" (Island of Stability) تُشير إلى أنه عند أعداد ذرية معينة (حول 114 أو 120 أو 126) قد توجد عناصر أكثر استقراراً من جيرانها، لكن هذا لم يُثبت تجريبياً بشكل قاطع بعد.
إحصائية مثيرة
من بين 118 عنصراً في الجدول الدوري، 80 عنصراً فقط لها نظير مستقر واحد على الأقل، والبقية جميعها مشعة تتحلل بمرور الوقت.
خصائص العناصر الدورية: ماذا يعني "الدوري" في الاسم؟
اسم "الجدول الدوري" مشتق من الدورية (Periodicity)؛ أي تكرار الخصائص بنمط منتظم. عندما ترتب العناصر حسب العدد الذري المتصاعد، تجد أن الخصائص الكيميائية والفيزيائية تتكرر بشكل دوري.
من أهم الخصائص الدورية نصف القطر الذري (Atomic Radius) الذي يقل عموماً من اليسار إلى اليمين في الدورة الواحدة (بسبب زيادة الشحنة النووية) ويزداد من الأعلى إلى الأسفل في المجموعة الواحدة (بسبب إضافة مستويات طاقة). طاقة التأين (Ionization Energy) — أي الطاقة اللازمة لنزع إلكترون من الذرة — تزداد من اليسار إلى اليمين وتقل من الأعلى إلى الأسفل. السالبية الكهربية (Electronegativity) — أي قدرة الذرة على جذب الإلكترونات المشتركة في الرابطة — تتبع نفس النمط تقريباً، والفلور هو أعلى العناصر سالبية كهربية.
فهم هذه الاتجاهات يُمكّنك من التنبؤ بسلوك العناصر دون الحاجة إلى حفظ كل التفاصيل، وهذا هو الجمال الحقيقي للجدول الدوري للعناصر.
نصائح عملية للطلاب العرب في دراسة الكيمياء
بناءً على تجارب كثير من الطلاب والمعلمين، إليك نصائح مجربة:
افهم قبل أن تحفظ: الجدول الدوري مبني على منطق علمي، وفهم هذا المنطق يجعل الحفظ أسهل بمراحل. لماذا الصوديوم يشبه البوتاسيوم؟ لأن كليهما في نفس المجموعة. هذا الفهم أقوى من الحفظ الأعمى.
استخدم مصادر متعددة: لا تكتفِ بالكتاب المدرسي. شاهد فيديوهات تعليمية بالعربية والإنكليزية، واستخدم تطبيقات تفاعلية، وحل تمارين متنوعة.
اربط بالواقع: كلما رأيت مادة في حياتك اليومية، فكر في تركيبها الكيميائي. الماء H₂O، الملح NaCl، السكر C₆H₁₂O₆. هذا الربط يجعل الكيمياء حية لا جافة.
لا تخف من المعادلات: كثير من الطلاب يهابون الرموز والمعادلات، لكنها في الحقيقة "اختصارات" توفر الوقت والجهد. تعامل معها كلغة جديدة تتعلمها تدريجياً.
اطرح الأسئلة: المعلم الجيد يُقدّر الطالب الذي يسأل. إذا لم تفهم شيئاً، اسأل فوراً ولا تتركه يتراكم.
تحميل الجدول الدوري للطباعة والاستخدام
يحتاج كل طالب وباحث إلى نسخة واضحة من الجدول الدوري للعناصر للرجوع إليها باستمرار. النسخ عالية الجودة تُظهر جميع المعلومات بوضوح: الرمز، الاسم بالعربية والإنكليزية، العدد الذري، الكتلة الذرية، التوزيع الإلكتروني، وأحياناً درجات الانصهار والغليان.
تتوفر نسخ متعددة: الوضع العادي (خلفية بيضاء للطباعة)، والوضع الليلي (Dark Mode) بخلفية داكنة مريحة للعين مناسبة كخلفية للهاتف أو الحاسوب، ونسخ ملونة حسب الفئات، ونسخ بسيطة للحفظ السريع. اختر ما يناسب احتياجاتك.
يمكنك تحميل الجدول بدقة عالية من هنا
الأسئلة الشائعة
سُمي بالجدول الدوري لأن خصائص العناصر الكيميائية والفيزيائية تتكرر بشكل دوري منتظم عند ترتيبها حسب العدد الذري المتصاعد، فالعناصر في كل مجموعة رأسية تتشابه في سلوكها الكيميائي.
نعم، يعمل العلماء حالياً على تخليق العنصرين 119 و120 باستخدام مسرعات الجسيمات العملاقة، لكن التحدي يكمن في عدم استقرار هذه العناصر فائقة الثقل وتحللها خلال أجزاء من الثانية.
يُوضع الهيدروجين في المجموعة الأولى لأنه يملك إلكتروناً واحداً في غلافه الخارجي مثل الفلزات القلوية، لكنه فريد ويُعامل أحياناً بشكل منفصل لأنه لافلز غازي وليس فلزاً صلباً.
بعض الرموز مشتقة من الأسماء اللاتينية أو اليونانية القديمة للعناصر، مثل الحديد رمزه Fe من اللاتينية Ferrum، والذهب رمزه Au من Aurum، والفضة Ag من Argentum.
الذرة أصغر وحدة من المادة تحتفظ بخصائص العنصر. العنصر مادة نقية من نوع واحد من الذرات. الجزيء ذرتان أو أكثر مترابطتان. المركب مادة من عنصرين أو أكثر متحدين كيميائياً بنسب ثابتة.
نعم، يُسمى ذلك التحول النووي ويحدث في المفاعلات النووية ومسرعات الجسيمات بتغيير عدد البروتونات في النواة. حلم الخيميائيين بتحويل الرصاص إلى ذهب ممكن نظرياً لكنه مُكلف جداً اقتصادياً.
يحتاج الجسم نحو 25 عنصراً أساسياً، أهمها الأكسجين والكربون والهيدروجين والنيتروجين والكالسيوم والفوسفور والبوتاسيوم والكبريت والصوديوم والكلور والمغنيسيوم، إضافة إلى عناصر نزرة كالحديد والزنك واليود.
الذهب فلز نبيل خامل كيميائياً ولا يتفاعل مع الأكسجين أو الرطوبة في الظروف العادية بسبب ثباته الإلكتروني العالي، بينما الحديد نشط كيميائياً ويتأكسد بسهولة مكوناً أكسيد الحديد المعروف بالصدأ.
أخف عنصر هو الهيدروجين بكتلة ذرية 1.008 وحدة كتل ذرية، وأثقل عنصر معروف هو الأوغانيسون بعدد ذري 118 وكتلة ذرية تُقدر بنحو 294 وحدة كتل ذرية.
نعم، عنصران فقط سائلان في درجة حرارة الغرفة العادية وهما الزئبق وهو فلز فضي لامع، والبروم وهو لافلز بني محمر. الغاليوم والسيزيوم يذوبان بحرارة اليد لأن درجة انصهارهما قريبة من حرارة الجسم.
الخاتمة
الجدول الدوري للعناصر ليس مجرد جدول يُحفظ للامتحانات ثم يُنسى، بل هو خريطة شاملة لبنية الكون المادي. من الهيدروجين الذي يُشعل النجوم إلى العناصر الثقيلة التي تُشكّل عظامنا وأجهزتنا، كل شيء موجود في هذا الجدول العبقري. لقد استغرق العلماء قروناً لاكتشاف النمط الخفي وترتيب الفوضى، ومندليف وموزلي وغيرهم بنوا صرحاً علمياً نستفيد منه اليوم في كل مجال.
الآن بعد أن فهمت بنية الجدول ومنطقه، وتعرفت على عائلات العناصر وخصائصها، وتعلمت طرق الحفظ الذكية، أصبحت مجهزاً للنجاح في دراسة الكيمياء وفهم العالم المادي من حولك بشكل أعمق.
إذا وجدت هذا المقال مفيداً، شاركه مع زملائك وأصدقائك الذين يدرسون الكيمياء. وإذا كان لديك سؤال أو استفسار، اتركه في التعليقات وسنجيبك. ما العنصر الذي أثار فضولك أكثر من غيره؟
قاموس المصطلحات العلمية للجدول الدوري
بنية الجدول الدوري وتنظيمه
الجدول الدوري للعناصر (Periodic Table of Elements)
التعريف: تنظيم منهجي للعناصر الكيميائية المعروفة (118 عنصراً) مرتبة تصاعدياً حسب أعدادها الذرية في 7 دورات أفقية و18 مجموعة رأسية، يُظهر تكرار الخصائص بنمط دوري منتظم.
العدد الذري (Atomic Number)
التعريف: عدد البروتونات الموجودة في نواة الذرة، وهو الرقم الذي يحدد هوية العنصر الكيميائي ولا يتكرر بين عنصرين مختلفين.
تبسيط: كبطاقة الهوية الشخصية؛ لكل عنصر رقم فريد يميزه عن غيره.
الدورات (Periods)
التعريف: الصفوف الأفقية السبعة في الجدول الدوري، تمثل عدد مستويات الطاقة (الأغلفة الإلكترونية) في ذرات العناصر الواقعة فيها.
المجموعات (Groups)
التعريف: الأعمدة الرأسية الثمانية عشر في الجدول الدوري، تضم عناصر متشابهة في عدد إلكترونات التكافؤ وبالتالي في السلوك الكيميائي.
الرمز الكيميائي (Chemical Symbol)
التعريف: اختصار مكون من حرف أو حرفين لاتينيين يمثل العنصر الكيميائي، مشتق غالباً من اسمه اللاتيني أو الإنجليزي (مثل: Fe للحديد، Au للذهب).
الكتلة الذرية (Atomic Mass)
التعريف: متوسط كتل النظائر الطبيعية للعنصر مقاسة بوحدة الكتل الذرية (amu)، وتظهر أسفل رمز العنصر في الجدول الدوري.
الفئات/الكتل (Blocks)
التعريف: تقسيم رباعي للعناصر (s, p, d, f) بناءً على المدار الذري الذي تشغله الإلكترونات الأخيرة، يحدد الموقع العام للعنصر في الجدول.
الخصائص الذرية الأساسية
مستويات الطاقة (Energy Levels)
التعريف: الأغلفة الإلكترونية المحيطة بنواة الذرة والتي تتوزع فيها الإلكترونات، يزداد عددها بالنزول في الجدول الدوري.
تبسيط: كطوابق مبنى؛ كلما ابتعدت عن النواة (الطابق الأرضي) ارتفعت طاقة الإلكترون.
إلكترونات التكافؤ (Valence Electrons)
التعريف: الإلكترونات الموجودة في المستوى الطاقي الخارجي للذرة، وهي المسؤولة عن السلوك الكيميائي وتكوين الروابط مع الذرات الأخرى.
تبسيط: كاليد الممدودة للمصافحة؛ هي ما تستخدمه الذرة للتفاعل مع جيرانها.
المدار الذري (Atomic Orbital)
التعريف: منطقة فراغية حول النواة يُرجَّح وجود الإلكترون فيها، له أشكال محددة (s كروي، p فصي، d و f أكثر تعقيداً).
نصف القطر الذري (Atomic Radius)
التعريف: نصف المسافة بين نواتي ذرتين متماثلتين مترابطتين، يقل من اليسار لليمين في الدورة ويزداد من الأعلى للأسفل في المجموعة.
طاقة التأين (Ionization Energy)
التعريف: الطاقة اللازمة لنزع إلكترون من ذرة متعادلة في الحالة الغازية، تزداد من اليسار لليمين في الدورة وتقل من الأعلى للأسفل في المجموعة.
السالبية الكهربية (Electronegativity)
التعريف: مقياس لقدرة الذرة على جذب الإلكترونات المشتركة في الرابطة الكيميائية نحوها، الفلور أعلى العناصر سالبية كهربية.
الدورية (Periodicity)
التعريف: تكرار الخصائص الكيميائية والفيزيائية للعناصر بنمط منتظم عند ترتيبها حسب العدد الذري المتصاعد، وهي أساس تسمية الجدول الدوري.
عائلات العناصر الكيميائية
الفلزات القلوية (Alkali Metals)
التعريف: عناصر المجموعة الأولى (Li, Na, K, Rb, Cs, Fr)، فلزات طرية لامعة شديدة التفاعل تملك إلكترون تكافؤ واحداً وتتفاعل بعنف مع الماء.
الفلزات القلوية الترابية (Alkaline Earth Metals)
التعريف: عناصر المجموعة الثانية (Be, Mg, Ca, Sr, Ba, Ra)، فلزات أقل نشاطاً من القلوية تملك إلكتروني تكافؤ وتكوّن أيونات ثنائية الشحنة الموجبة.
الفلزات الانتقالية (Transition Metals)
التعريف: عناصر الفئة d الواقعة في وسط الجدول (المجموعات 3-12)، تتميز بكثافتها وصلابتها ونقاط انصهارها المرتفعة وقدرتها على تكوين مركبات ملونة.
أشباه الفلزات (Metalloids)
التعريف: عناصر تقع على الخط الفاصل بين الفلزات واللافلزات وتجمع خصائص كلا النوعين، أهمها السيليكون والجرمانيوم المستخدمان في الإلكترونيات.
اللافلزات (Non-metals)
التعريف: عناصر الجانب الأيمن العلوي من الجدول، رديئة التوصيل للحرارة والكهرباء، تميل لاكتساب الإلكترونات، وتشمل عناصر الحياة الأساسية (C, N, O, S, P).
الهالوجينات (Halogens)
التعريف: عناصر المجموعة 17 (F, Cl, Br, I, At)، لافلزات شديدة التفاعل تملك 7 إلكترونات تكافؤ وتميل لاكتساب إلكترون واحد للوصول للاستقرار.
الغازات النبيلة (Noble Gases)
التعريف: عناصر المجموعة 18 (He, Ne, Ar, Kr, Xe, Rn)، غازات خاملة كيميائياً لاكتمال غلافها الإلكتروني الخارجي، تُستخدم في بيئات تتطلب عدم التفاعل.
اللانثانيدات (Lanthanides)
التعريف: سلسلة العناصر من 57 إلى 71 المفصولة أسفل الجدول، تُسمى العناصر الأرضية النادرة ولها تطبيقات في المغناطيسات والليزر.
الأكتينيدات (Actinides)
التعريف: سلسلة العناصر من 89 إلى 103 المفصولة أسفل الجدول، جميعها مشعة وتضم اليورانيوم والبلوتونيوم المستخدمين في الطاقة النووية.
المفاهيم المتقدمة والتطبيقية
أشباه الموصلات (Semiconductors)
التعريف: مواد توصيلها الكهربائي يقع بين الموصلات والعوازل ويمكن التحكم فيه، أساس صناعة الإلكترونيات الحديثة (الترانزستورات والرقائق).
تبسيط: كصنبور الماء؛ يمكن فتحه أو إغلاقه للتحكم في تدفق الكهرباء.
التشويب (Doping)
التعريف: عملية إضافة شوائب محددة بكميات ضئيلة إلى شبه الموصل النقي لتغيير خصائصه الكهربائية وجعله موصلاً أو عازلاً حسب الحاجة.
النظائر المشعة (Radioactive Isotopes)
التعريف: ذرات لعنصر واحد تختلف في عدد النيوترونات وتكون غير مستقرة فتُصدر إشعاعاً، تُستخدم في التشخيص الطبي وعلاج السرطان.
العناصر فائقة الثقل (Superheavy Elements)
التعريف: عناصر اصطناعية ذات أعداد ذرية عالية (فوق 103) تُصنَّع في المختبرات عبر تصادم نوى ذرية، غير مستقرة وتتحلل خلال أجزاء من الثانية.
جزيرة الاستقرار (Island of Stability)
التعريف: نظرية تُشير إلى وجود عناصر فائقة الثقل عند أعداد ذرية معينة (حول 114 أو 120 أو 126) قد تكون أكثر استقراراً من جيرانها.
التحول النووي (Nuclear Transmutation)
التعريف: تحويل عنصر كيميائي إلى عنصر آخر بتغيير عدد البروتونات في النواة، يحدث في المفاعلات النووية ومسرعات الجسيمات.
المصادر والمراجع
الدراسات والأوراق البحثية
Scerri, E. R. (2020). The Periodic Table: Its Story and Its Significance. Oxford University Press. DOI: 10.1093/oso/9780190914363.001.0001
كتاب شامل يتناول تاريخ الجدول الدوري وأهميته الفلسفية والعلمية.
Schwarz, W. H. E. (2010). The Full Story of the Electron Configurations of the Transition Elements. Journal of Chemical Education, 87(4), 444-448. DOI: 10.1021/ed8001286
دراسة تشرح التوزيع الإلكتروني للفلزات الانتقالية بالتفصيل.
Pyykkö, P. (2019). An essay on periodic tables. Pure and Applied Chemistry, 91(12), 1959-1967. DOI: 10.1515/pac-2019-0801
مقال تحليلي عن الأشكال المختلفة للجدول الدوري ومستقبله.
Karol, P. J., et al. (2016). Discovery of the elements with atomic numbers 113, 115, 117 and 118. Pure and Applied Chemistry, 88(1-2), 139-153. DOI: 10.1515/pac-2015-0502
الورقة الرسمية للاعتراف بالعناصر الأربعة الأخيرة في الجدول.
Cao, C., & Vernon, R. E. (2021). Metalloids: A call for clarity. Chemistry International, 43(2), 18-21. DOI: 10.1515/ci-2021-0204
مناقشة حول تعريف أشباه الفلزات وتصنيفها.
Leach, M. R. (2020). The Internet Database of Periodic Tables. Foundations of Chemistry, 22, 315-324. DOI: 10.1007/s10698-019-09350-7
دراسة عن الأشكال المتنوعة للجدول الدوري عبر التاريخ.
الجهات الرسمية والمنظمات
IUPAC (International Union of Pure and Applied Chemistry). Periodic Table of Elements.
https://iupac.org/what-we-do/periodic-table-of-elements/
المصدر الرسمي للأسماء والرموز والأوزان الذرية المعتمدة.
Royal Society of Chemistry. Periodic Table.
https://www.rsc.org/periodic-table
جدول تفاعلي يحتوي على معلومات شاملة عن كل عنصر.
National Institute of Standards and Technology (NIST). Atomic Weights and Isotopic Compositions.
https://www.nist.gov/pml/atomic-weights-and-isotopic-compositions
البيانات الرسمية للأوزان الذرية والتركيب النظائري.
Los Alamos National Laboratory. Periodic Table of Elements.
https://periodic.lanl.gov/
معلومات تفصيلية عن كل عنصر من مختبر لوس ألاموس.
MIT OpenCourseWare. Principles of Chemical Science.
https://ocw.mit.edu/courses/chemistry/
دورات مجانية في الكيمياء من معهد ماساتشوستس للتقنية.
الكتب والموسوعات العلمية
Emsley, J. (2011). Nature's Building Blocks: An A-Z Guide to the Elements. Oxford University Press.
موسوعة شاملة عن جميع العناصر بأسلوب سهل وممتع.
Gray, T., & Mann, N. (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe. Black Dog & Leventhal.
كتاب مصور رائع يعرض العناصر بصور حقيقية عالية الجودة.
Sacks, O. (2001). Uncle Tungsten: Memories of a Chemical Boyhood. Vintage.
سيرة ذاتية أدبية تمزج قصص العناصر بذكريات الطفولة.
مقالات علمية مبسطة
Scientific American. The Periodic Table Turns 150.
https://www.scientificamerican.com/article/the-periodic-table-turns-150/
مقال بمناسبة مرور 150 عاماً على اختراع الجدول الدوري.
قراءات إضافية مقترحة للتعمق
1. كتاب "The Disappearing Spoon" لسام كين (Sam Kean, 2010)
لماذا نقترحه؟ هذا الكتاب يروي قصصاً مشوقة وطريفة عن اكتشاف العناصر والعلماء وراءها، بأسلوب قصصي يجعلك تشعر وكأنك تقرأ رواية لا كتاباً علمياً. يتناول الكتاب حكايات غريبة مثل العالم الذي حاول تحويل الرصاص إلى ذهب، والعنصر الذي سُمي على اسم قرية سويدية صغيرة، والمعارك العلمية حول أسبقية الاكتشافات. إذا كنت تبحث عن مدخل ممتع إلى عالم الجدول الدوري للعناصر، فهذا الكتاب هو خيارك الأمثل.
2. كتاب "Nature's Building Blocks" لجون إمسلي (John Emsley, 2011)
لماذا نقترحه؟ يُعَدُّ هذا الكتاب موسوعة مرجعية شاملة يمكنك الرجوع إليها كلما احتجت معلومات عن أي عنصر. يُقدم كل عنصر في صفحات مستقلة تشمل تاريخ اكتشافه، وخصائصه الفيزيائية والكيميائية، واستخداماته الصناعية والطبية، وتأثيراته البيئية والصحية، بل وحتى وجوده في الأدب والثقافة الشعبية. إنه الرفيق المثالي لكل طالب أو باحث أو معلم يتعامل مع الكيمياء.
3. كتاب "The Periodic Table" لبريمو ليفي (Primo Levi, 1975)
لماذا نقترحه؟ هذا الكتاب فريد من نوعه؛ إذ يمزج بين السيرة الذاتية والكيمياء والأدب بطريقة لم يسبقه إليها أحد. المؤلف — وهو كيميائي إيطالي نجا من معسكرات الاعتقال النازية — يروي فصول حياته مستخدماً العناصر الكيميائية كاستعارات ورموز. كل فصل يحمل اسم عنصر ويرتبط بمرحلة من حياته أو بتجربة إنسانية عميقة. الجمعية الملكية البريطانية اختارته "أفضل كتاب علمي على الإطلاق" عام 2006. إذا كنت تريد أن ترى الجدول الدوري للعناصر بعيون شاعر وفيلسوف، فهذا الكتاب لك.
ملحوظة ختامية: الجدول الدوري للعناصر هو أحد أعظم إنجازات العقل البشري في تنظيم المعرفة العلمية. ما بدأ كمحاولات متفرقة لتصنيف المواد أصبح اليوم الأداة الأساسية التي يعتمد عليها كل كيميائي وفيزيائي وبيولوجي ومهندس في العالم. وكلما تعمقت في فهمه، اكتشفت أن وراء كل رمز وكل رقم قصة علمية رائعة وتطبيقات لا حصر لها تمس حياتك اليومية.
شاركنا في التعليقات: ما هو العنصر الذي أدهشتك معلوماته أكثر من غيره؟ وهل لديك طريقة خاصة لحفظ الجدول الدوري تريد مشاركتها مع القراء؟
تحذير وإخلاء مسؤولية
- التجارب الكيميائية: بعض العناصر المذكورة في هذا المقال شديدة التفاعل أو سامة أو مشعة. لا تحاول إجراء أي تجارب كيميائية دون إشراف متخصص وفي مختبر مجهز بمعدات السلامة.
- الفلزات القلوية: مثل الصوديوم والبوتاسيوم تنفجر عند ملامستها للماء — لا تتعامل معها خارج المختبرات المتخصصة.
- المعلومات التعليمية: هذا المقال لأغراض تعليمية فقط ولا يُغني عن الكتب الأكاديمية المعتمدة أو إرشادات المعلمين والأساتذة.
- المصادر: رغم حرصنا على دقة المعلومات، ننصح بالتحقق من المصادر الأصلية والمراجع العلمية المُحكّمة.
موسوعة خلية العلمية غير مسؤولة عن أي أضرار ناتجة عن سوء استخدام المعلومات الواردة في هذا المقال.
بيان المصداقية
نلتزم في موسوعة خلية العلمية بأعلى معايير الدقة والمصداقية في المحتوى العلمي الذي نُقدمه:
- المصادر الموثوقة: نعتمد على الأوراق البحثية المُحكّمة والمنظمات العلمية الرسمية مثل IUPAC وNIST.
- التحديث المستمر: نُراجع مقالاتنا دورياً لتحديث المعلومات وفق أحدث الاكتشافات العلمية.
- الشفافية: نُدرج جميع المصادر والمراجع في نهاية كل مقال ليتمكن القارئ من التحقق والتعمق.
- فريق متخصص: يُراجع المحتوى فريق من المحررين ذوي الخلفية العلمية.
- لا تضارب مصالح: لا نتلقى أي تمويل من جهات قد تؤثر على موضوعية المحتوى.
المراجع العلمية الرسمية المعتمدة
تم التحقق من معلومات هذا المقال بالاعتماد على المصادر العلمية الموثوقة التالية:
- IUPAC — الاتحاد الدولي للكيمياء البحتة والتطبيقية (الجهة الرسمية لتسمية العناصر)
- NIST — المعهد الوطني الأمريكي للمعايير والتقنية (بيانات الأوزان الذرية)
- Royal Society of Chemistry — الجمعية الملكية للكيمياء
- Nature Chemistry — دورية علمية مُحكّمة
- Journal of Chemical Education — مجلة التعليم الكيميائي
جرت مراجعة هذه المقالة
المراجعة العلمية: فريق التحرير في موسوعة خلية العلمية
آخر تحديث: يناير 2026
حالة المراجعة: تمت المراجعة ✓
إذا وجدت أي خطأ أو لديك اقتراح لتحسين المحتوى، يُرجى التواصل معنا. نُقدّر ملاحظاتكم ونسعى دائماً لتقديم محتوى علمي دقيق وموثوق.
مقال مُراجَع علمياً
معايير المراجعة المُتّبعة:
✓ التوافق مع بيانات IUPAC الرسمية
✓ مراجعة الأرقام والرموز الكيميائية
✓ التحقق من المصادر والمراجع العلمية
✓ مراجعة لغوية وعلمية شاملة
آخر تحديث: يناير 2026 | الحالة: معتمد ✓





