الإسترات: ما هي وكيف تُستخدم في الصناعة والعطور والطب؟
لماذا تمنحنا الفواكه روائحها ونكهاتها المميزة؟

الإسترات مركبات عضوية تنتج من تفاعل حمض كربوكسيلي مع كحول بوجود حفّاز حمضي، وتحمل المجموعة الوظيفية (R-COO-R’). تتميز بروائحها الزكية التي تشبه الفواكه، وتدخل في صناعة المنكّهات الغذائية والأدوية والبوليمرات والمذيبات. كما تشكّل الدهون والزيوت الطبيعية أبرز أمثلتها في الكائنات الحية.
هل تساءلت يوماً عن السرّ وراء رائحة الموز الطازج أو نكهة الأناناس في مشروبك المفضّل؟ ربما كنت تدرس الكيمياء العضوية وشعرت بأن هذا الفصل معقّد أو مليء بالمعادلات الجافة. الحقيقة أنك تتعامل مع الإسترات يومياً دون أن تدري. كل مرة تشمّ فيها عطراً فوّاحاً، أو تتناول قرص أسبرين، أو حتى ترتدي قميصاً من البوليستر، فأنت في قلب عالم هذه المركبات. في هذا المقال ستجد شرحاً عملياً ومبسّطاً يربط بين ما تقرؤه في الكتب وبين ما تعيشه فعلاً، وهو ما سيجعل المعلومة تثبت في ذهنك بلا عناء.
📝 خلاصة المقال في دقيقة واحدة
ما تحتاج معرفته فوراً
- الأسترات مركبات عضوية بمجموعة وظيفية (R-COO-R’) تنتج من تفاعل حمض كربوكسيلي مع كحول.
- الدهون والزيوت التي نأكلها يومياً هي إسترات ضخمة (دهون ثلاثية)، والأسبرين أشهر إستر دوائي في العالم.
- الأسترات ذات الكتل الجزيئية المنخفضة هي المسؤولة عن روائح الفواكه ونكهاتها المميزة.
حقائق علمية جوهرية
- درجات غليان الأسترات أقل من الكحولات والأحماض المماثلة لأنها لا تكوّن روابط هيدروجينية بين جزيئاتها.
- تفاعل أسترة فيشر عكسي ويحتاج حفّازاً حمضياً، بينما تفاعل التصبن (تحلل قاعدي) غير عكسي وينتج الصابون.
- بولي إيثيلين تيريفثالات (PET) بوليمر إستري يتجاوز إنتاجه 30 مليون طن سنوياً عالمياً.
تحذيرات مهمة
- الأسترات المذيبة (مثل إيثانوات الإيثيل) شديدة الاشتعال بنقطة وميض -4 °C؛ تعامل معها في بيئة مهوّأة بعيداً عن اللهب.
- لا تنفّذ تجارب الأسترة المنزلية دون إشراف متخصص ومعدّات سلامة مناسبة.
ما هي الإسترات وكيف تبدو بنيتها الكيميائية؟
تخيّل أنك في مختبر الكيمياء بالجامعة، ووضعت بضع قطرات من حمض الخلّيك (الموجود في الخلّ) مع كحول الإيثانول في أنبوب اختبار، ثم أضفت نقطتين من حمض الكبريتيك المركّز وسخّنت الخليط في حمام مائي لعشر دقائق. بعد ذلك ستلاحظ رائحة حلوة تشبه رائحة طلاء الأظافر أو الفواكه تنبعث من الأنبوب. هذا المنتج هو إيثانوات الإيثيل، أحد أبسط الإسترات وأكثرها شيوعاً. لقد صنعت إستراً بيديك من مواد موجودة في مطبخك تقريباً.
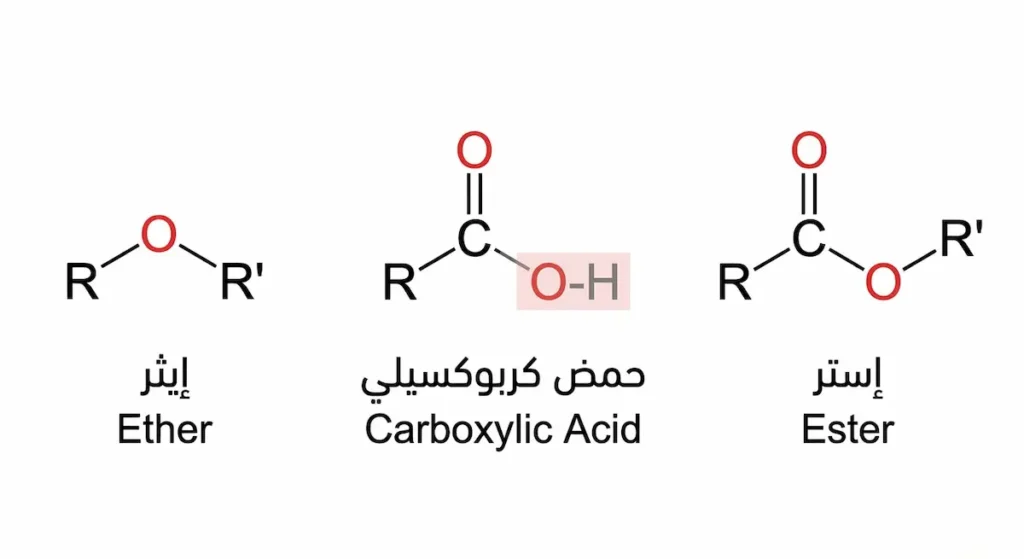
المجموعة الوظيفية التي تميّز مجموعة الإستر الوظيفية هي الترتيب (R-COO-R’)؛ إذ ترتبط ذرة كربون مركزية بذرة أكسجين برابطة مزدوجة (C=O)، وبذرة أكسجين أخرى برابطة أحادية (C-O)، وهذه الأكسجين الثانية ترتبط بدورها بمجموعة ألكيل أو أريل. فما الفرق الجوهري بين هذا التركيب وبين الأحماض الكربوكسيلية (Carboxylic Acids)؟ الإجابة بسيطة: في الحمض الكربوكسيلي يوجد هيدروجين حمضي (O-H) مرتبط بالأكسجين، بينما في الإسترات يُستبدل هذا الهيدروجين بمجموعة كربونية (R’). هذا الاستبدال البسيط يغيّر الخواص تغييراً جذرياً؛ فيختفي الطعم الحامض وتظهر الرائحة العطرية.
الصيغة العامة للإسترات تُكتب عادةً على الشكل: CₙH₂ₙO₂ (في حالة الأسترات المشبّعة أحادية المجموعة الوظيفية). وكذلك يمكن التعبير عنها بصيغة بنائية أوضح: RCOOR’ حيث R تمثل الشقّ القادم من الحمض، وR’ تمثل الشقّ القادم من الكحول.
💡 حقيقة كيميائية لافتة
الفرق بين الإسترات والإيثرات (Ethers) يُربك كثيراً من الطلاب. كلاهما يحتوي على ذرة أكسجين بين مجموعتي كربون، لكن الإستر يتميز بوجود مجموعة الكربونيل (C=O) المجاورة، بينما الإيثر يحمل فقط روابط أحادية (R-O-R’). هذا الفرق يمنح الإسترات تفاعلية أعلى بكثير.
اقرأ أيضاً: الروابط الكيميائية: الأنواع، التكوين، والخصائص
🧮 أداة: حاسبة الكتلة الجزيئية للإسترات الشائعة
اختر الإستر من القائمة لتعرف كتلته الجزيئية وصيغته الكيميائية فوراً.
المصدر: قاعدة بيانات PubChem – المعهد الوطني للصحة الأمريكي (NIH)
كيف نسمّي الإسترات وفق نظام IUPAC والأسماء الشائعة؟
تسمية الإسترات تتبع منطقاً أنيقاً بمجرد أن تفهمه لن تنساه. لنبدأ بالخطوات العملية.
كيف تشتقّ الاسم خطوة بخطوة؟
القاعدة ببساطة: الاسم يتكوّن من جزأين. الجزء الأول يأتي من الحمض الكربوكسيلي الأصلي، والجزء الثاني من الكحول. في نظام IUPAC نُسمّي شقّ الحمض أولاً بتحويل لاحقته من “-يك” (ic) إلى “-وات” (oate)، ثم نذكر اسم مجموعة الألكيل القادمة من الكحول. مثلاً: حمض الإيثانويك (Ethanoic acid) + ميثانول (Methanol) = إيثانوات الميثيل (Methyl ethanoate).
في الأسماء الشائعة (Common Names) نتّبع المنطق نفسه لكن باستخدام أسماء الأحماض الشائعة. فحمض الخلّيك + ميثانول = خلّات الميثيل (Methyl acetate).
ما أبرز الأمثلة على تسمية الإسترات؟
| الحمض الأصلي | الكحول | اسم الإستر (IUPAC) | الاسم الشائع |
|---|---|---|---|
| حمض الميثانويك (Formic acid) |
ميثانول (Methanol) |
ميثانوات الميثيل (Methyl methanoate) |
فورمات الميثيل |
| حمض الإيثانويك (Acetic acid) |
إيثانول (Ethanol) |
إيثانوات الإيثيل (Ethyl ethanoate) |
خلّات الإيثيل |
| حمض البيوتانويك (Butyric acid) |
إيثانول (Ethanol) |
بيوتانوات الإيثيل (Ethyl butanoate) |
زبدات الإيثيل |
| حمض البنزويك (Benzoic acid) |
ميثانول (Methanol) |
بنزوات الميثيل (Methyl benzoate) |
بنزوات الميثيل |
| حمض الساليسيليك (Salicylic acid) |
ميثانول (Methanol) |
ساليسيلات الميثيل (Methyl salicylate) |
زيت المروخ |
| المصدر: الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) | |||
هذا الجدول يلخّص أهم ما تحتاجه لفهم تسمية الإسترات سواء في الامتحانات الجامعية أو في التطبيقات الصناعية.
لماذا تمتلك الإسترات خواص فيزيائية مختلفة عن الكحولات والأحماض؟
خواص الإسترات الفيزيائية تكشف عن طبيعتها الجزيئية الفريدة. لنبدأ بالسؤال المحوري: لماذا درجات غليان الإسترات أقل من درجات غليان الأحماض الكربوكسيلية والكحولات التي لها نفس الكتلة الجزيئية؟
السرّ يكمن في الروابط الهيدروجينية (Hydrogen Bonds). الكحولات والأحماض تستطيع تكوين روابط هيدروجينية قوية بين جزيئاتها لأنها تمتلك ذرة هيدروجين مرتبطة بأكسجين (O-H). على النقيض من ذلك، الأسترات لا تمتلك هذا الهيدروجين القابل لتكوين رابطة هيدروجينية بين جزيئاتها. نعم، يمكنها تكوين روابط هيدروجينية مع الماء (لأن الأكسجين فيها يعمل كمستقبِل)، لكنها لا تستطيع ذلك مع بعضها البعض. وبالتالي فإن قوى التجاذب بين جزيئاتها أضعف، فتغلي عند درجات حرارة أقل.
أما بخصوص الذوبانية في الماء، فالإسترات ذات السلاسل القصيرة (مثل ميثانوات الميثيل وإيثانوات الميثيل) تذوب جزئياً في الماء بسبب قدرتها على تكوين روابط هيدروجينية مع جزيئات الماء. لكن مع زيادة طول السلسلة الكربونية، تزداد الطبيعة غير القطبية (Hydrophobic) للجزيء فتقلّ الذوبانية بشكل ملحوظ.
ومما يجعل الإسترات محبّبة لدى الكيميائيين والمستهلكين على حدّ سواء هو رائحتها المميزة. معظم الأسترات ذات الكتل الجزيئية المنخفضة تمتلك روائح فواكه زكية، وهذه الخاصية هي أساس استخدامها في صناعة المنكّهات والعطور.
| المركب | الصنف | الكتلة الجزيئية (g/mol) |
درجة الغليان (°C) |
الذوبانية في الماء | الروابط الهيدروجينية بين الجزيئات |
|---|---|---|---|---|---|
| إيثانوات الميثيل (Methyl acetate) |
إستر | 74 | 57 | جزئية | ❌ غير موجودة |
| بروبان-1-أول (Propan-1-ol) |
كحول | 60 | 97 | تامة | ✅ قوية |
| حمض الإيثانويك (Acetic acid) |
حمض كربوكسيلي | 60 | 118 | تامة | ✅ قوية جداً (ثنائيات) |
| المصدر: قاعدة بيانات PubChem – المعهد الوطني للصحة الأمريكي (NIH) | |||||
📌 معلومة تستحق التوقف
إيثانوات الإيثيل (Ethyl acetate) هو المذيب الذي تشمّينه عند استخدام مزيل طلاء الأظافر. رائحته الحلوة النفّاذة هي في الواقع رائحة إستر نقي. يُعَدُّ من أكثر المذيبات العضوية استخداماً في العالم بإنتاج سنوي يتجاوز 3.5 مليون طن.
المصدر: الوكالة الأوروبية للمواد الكيميائية (ECHA) – ملف إيثانوات الإيثيل
اقرأ أيضاً: الضغط البخاري (Vapor Pressure): المفهوم، العوامل المؤثرة، والتطبيقات
أين نجد الإسترات في الطبيعة وفي حياتنا اليومية؟
الإسترات في الحياة اليومية أكثر انتشاراً مما تتصوّر. فهي ليست مجرد مركبات مختبرية، بل هي جزء أساسي من الطعام الذي نأكله والدهون التي يخزّنها جسمنا.
ما الإسترات المسؤولة عن نكهات الفواكه؟
لماذا تتميز الإسترات بروائح الفواكه؟ لأن جزيئاتها الصغيرة المتطايرة تصل بسهولة إلى المستقبلات الشمية في الأنف، وتركيبها الجزيئي يتوافق مع مستقبلات محددة تُرسل إشارات عصبية يفسّرها الدماغ كروائح فاكهية. إليك جدولاً توضيحياً:
| الإستر | الصيغة الكيميائية | النكهة / الرائحة |
|---|---|---|
| بنتانوات الإيثيل (Ethyl pentanoate) |
C₂H₅OOCC₄H₉ | 🍎 تفاح |
| إيثانوات الأيزوأميل (Isoamyl acetate) |
CH₃COOC₅H₁₁ | 🍌 موز |
| بيوتانوات الإيثيل (Ethyl butyrate) |
C₂H₅OOCC₃H₇ | 🍍 أناناس |
| بيوتانوات الميثيل (Methyl butyrate) |
CH₃OOCC₃H₇ | 🍑 مشمش |
| أوكتانوات الإيثيل (Ethyl octanoate) |
C₂H₅OOCC₇H₁₅ | 🍊 برتقال |
| المصدر: إدارة الغذاء والدواء الأمريكية (FDA) – قائمة المنكّهات GRAS | ||
هذا الجدول يوضّح أمثلة على الإسترات واستخداماتها الأساسية في عالم النكهات.
🍎 أداة: مُعرِّف روائح الإسترات – اختر الفاكهة واكتشف الإستر
اختر رائحة أو نكهة الفاكهة لتعرف الإستر المسؤول عنها وصيغته الكيميائية واستخدامه الصناعي.
المصدر: إدارة الغذاء والدواء الأمريكية (FDA) – قائمة المنكّهات GRAS
كيف ترتبط الدهون والزيوت بالإسترات؟
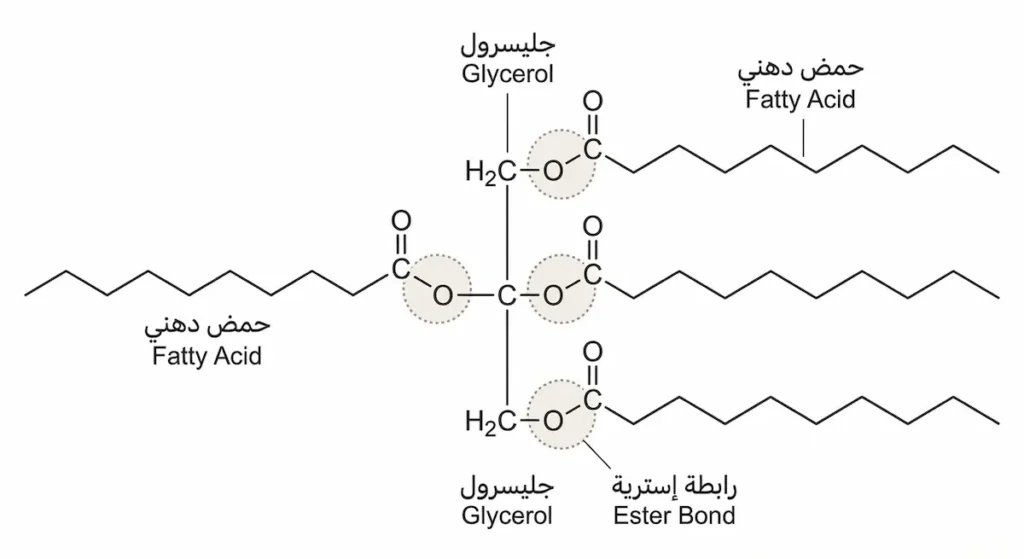
الدهون والزيوت (Fats and Oils) التي نستهلكها يومياً هي في جوهرها إسترات ضخمة تُعرف بالدهون الثلاثية (Triglycerides). تتكوّن من تفاعل ثلاثة أحماض دهنية (Fatty Acids) مع جزيء واحد من الجليسرول (Glycerol) الذي هو كحول ثلاثي الهيدروكسيل.
إن فهمت هذه النقطة، فقد فهمت أساس الكيمياء الحيوية للدهون. زيت الزيتون مثلاً الذي يُستخدم بكثرة في المطبخ السعودي والعربي هو خليط من إسترات الجليسرول مع أحماض دهنية أحادية عدم التشبّع، أبرزها حمض الأوليك (Oleic acid). فقد أثبتت دراسة منشورة في مجلة Molecules عام 2019 أن التركيب الإستري لزيت الزيتون البكر يرتبط ارتباطاً مباشراً بخصائصه المضادة للأكسدة وفوائده القلبية (Gorzynik-Debicka et al., 2019, DOI: 10.3390/molecules23102684).
اقرأ أيضاً: الدهون المشبعة: ما حقيقتها وكيف تؤثر على صحتك؟
هل الشموع أيضاً إسترات؟
نعم. الشموع الطبيعية (Waxes) مثل شمع العسل وشمع الكرنوبا (Carnauba wax) هي إسترات تتكوّن من أحماض دهنية طويلة السلسلة مع كحولات طويلة السلسلة أيضاً. هذه الإسترات “العملاقة” غير قابلة للذوبان في الماء تقريباً، وتمتلك نقاط انصهار مرتفعة نسبياً. شمع العسل مثلاً يحتوي على بالميتات الميريسيل (Myricyl palmitate) كمكوّن رئيس. في السعودية، يحظى شمع العسل الطبيعي بتقدير خاص في الأسواق التقليدية ويدخل في منتجات العناية بالبشرة المحلية.
🔎 هل تعلم؟
الطبقة اللامعة على سطح التفاح والبرتقال هي في الحقيقة طبقة رقيقة من الشموع الطبيعية (إسترات طويلة السلسلة) تفرزها الثمرة لحماية نفسها من فقدان الماء والتلوث الميكروبي.
كيف نحضّر الإسترات في المختبر والصناعة؟
كيفية تحضير الإسترات في المختبر تعتمد على عدة طرق، لكن أشهرها على الإطلاق هو تفاعل أسترة فيشر.
ما آلية تفاعل أسترة فيشر (Fischer Esterification)؟
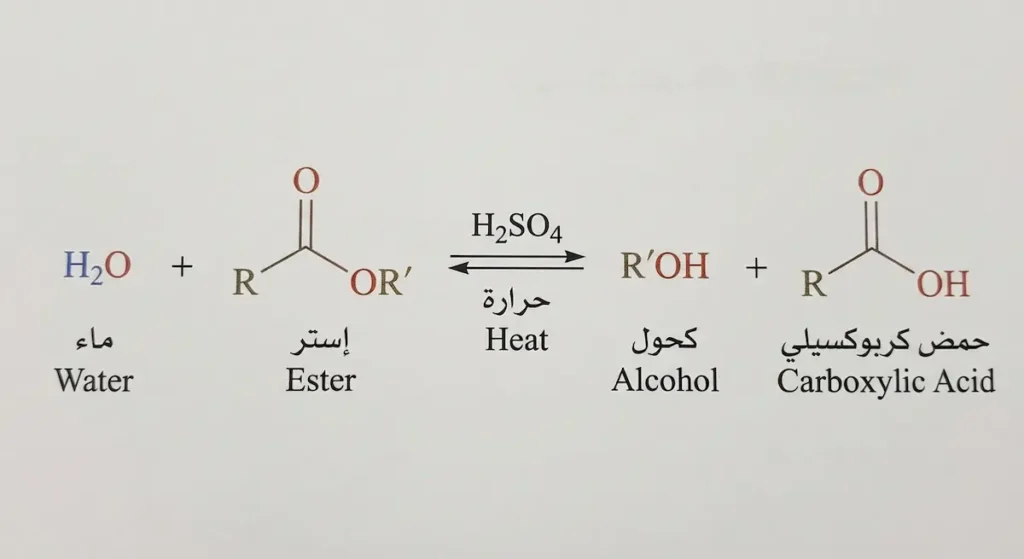
هذا التفاعل سُمّي نسبةً إلى الكيميائي الألماني إميل فيشر (Emil Fischer) الذي وصفه في نهاية القرن التاسع عشر. ميكانيكية تفاعل أسترة فيشر تسير كالتالي:
يتفاعل حمض كربوكسيلي مع كحول بوجود حفّاز حمضي (عادةً حمض الكبريتيك المركّز H₂SO₄) وتسخين. ينتج عن التفاعل إستر وماء.
RCOOH + R’OH ⇌ RCOOR’ + H₂O
نقطة مهمة جداً: هذا التفاعل عكسي (Reversible)؛ إذ يصل إلى حالة اتزان (Equilibrium) ولا يسير حتى النهاية. وعليه فإن الكيميائي يحتاج إلى حيل لزيادة المردود. من أبرزها: استخدام فائض من أحد المتفاعلات (عادةً الكحول لأنه أرخص)، أو إزالة الماء الناتج باستمرار لدفع الاتزان نحو تكوّن مزيد من الإستر (مبدأ لوشاتلييه – Le Chatelier’s Principle).
بالنسبة لميكانيكية التفاعل بالتفصيل: يبدأ الحفّاز الحمضي ببروتنة (Protonation) ذرة أكسجين الكربونيل في الحمض الكربوكسيلي، مما يجعل ذرة الكربون أكثر ميلاً لاستقبال الهجوم النيوكليوفيلي (Nucleophilic Attack) من أكسجين الكحول. يتبع ذلك سلسلة من خطوات نقل البروتون وفقدان الماء لتتشكّل الرابطة الإسترية الجديدة.
دور حمض الكبريتيك هنا ليس كمتفاعل بل كحفّاز فقط؛ فهو يُسرّع التفاعل دون أن يُستهلك. كما أنه يعمل كعامل نازع للماء (Dehydrating agent) مما يساعد في دفع الاتزان.
اقرأ أيضاً: طاقة التنشيط: كيف تتحكم في سرعة التفاعلات الكيميائية؟
هل يمكن تحضير الإسترات بطرق أسرع وأكفأ؟
بالتأكيد. من ناحية أخرى، يمكن تحضير الأسترات من كلوريدات الأحماض (Acid Chlorides) أو أنهيدريدات الأحماض (Acid Anhydrides) بدلاً من الأحماض الكربوكسيلية نفسها.
عند استخدام كلوريد الأسيل (مثل كلوريد الأسيتيل CH₃COCl)، يتفاعل مع الكحول بسرعة أكبر ويُعطي مردوداً أعلى لأن التفاعل غير عكسي عملياً. الناتج الثانوي هو حمض الهيدروكلوريك (HCl) بدلاً من الماء.
CH₃COCl + C₂H₅OH → CH₃COOC₂H₅ + HCl
كذلك فإن تفاعل أنهيدريد الخلّيك (Acetic anhydride) مع الكحول يُعَدُّ أكثر أماناً وسهولة في التطبيق الصناعي. وهذا هو التفاعل الذي يُستخدم فعلياً في تصنيع الأسبرين (Aspirin)؛ إذ يتفاعل أنهيدريد الخلّيك مع المجموعة الهيدروكسيلية في حمض الساليسيليك لتكوين حمض الأسيتيل ساليسيليك.
🏭 لمحة صناعية مثيرة
في المملكة العربية السعودية، تنتج شركة سابك (SABIC) ومصانع البتروكيماويات في الجبيل وينبع كميات ضخمة من الإيثانول والأحماض العضوية التي تُستخدم كمواد خام لتصنيع الإسترات المذيبة والبوليمرات. قطاع البتروكيماويات السعودي يُعَدُّ من أكبر خمسة منتجين عالمياً للمواد الأولية التي تدخل في تخليق الأسترات الصناعية.
المصدر: الموقع الرسمي لشركة سابك (SABIC)
اقرأ أيضاً: الاقتصاد السعودي: كيف تحول من الاعتماد على النفط إلى التنويع الشامل؟
ما التفاعلات الكيميائية الرئيسة التي تخضع لها الإسترات؟
فهم تفاعلات الإسترات الكيميائية ضروري لكل طالب كيمياء. الرابطة الإسترية (C-O) قابلة للكسر بعدة طرق، وأهمها ثلاث.
كيف يحدث التحلل المائي الحمضي (Acidic Hydrolysis)؟
التحلل المائي للإستر في وسط حمضي هو ببساطة عكس تفاعل الأسترة. نأخذ الإستر ونضيف إليه ماءً بوجود حفّاز حمضي وتسخين، فنحصل مجدداً على الحمض الكربوكسيلي والكحول الأصليين.
RCOOR’ + H₂O ⇌ RCOOH + R’OH
هذا التفاعل أيضاً عكسي، مما يعني أن المردود لن يكون كاملاً إلا إذا استخدمنا فائضاً كبيراً من الماء.
ما هو تفاعل التصبن (Saponification) وكيف يُصنع الصابون؟
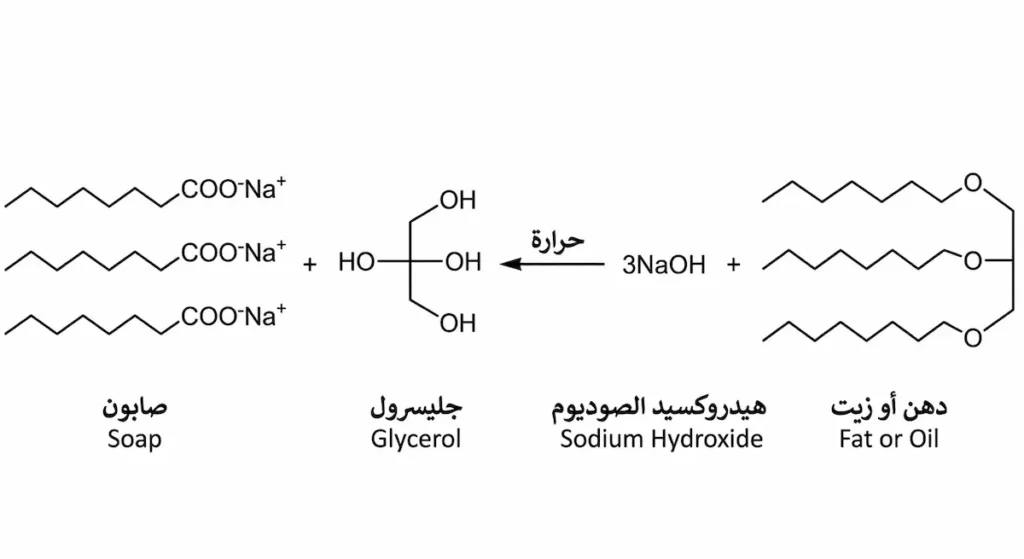
تفاعل التصبن هو التحلل المائي القاعدي للإستر، وهو من أقدم التفاعلات الكيميائية التي عرفتها البشرية. عند تسخين دهن حيواني أو زيت نباتي (وكلاهما إسترات) مع محلول هيدروكسيد الصوديوم (NaOH) المركّز، تنكسر الروابط الإسترية وينتج الجليسرول (Glycerol) وأملاح الأحماض الدهنية التي هي الصابون نفسه.
RCOOR’ + NaOH → RCOONa + R’OH
الفرق الجوهري بين التحلل الحمضي والقاعدي: تفاعل التصبن غير عكسي (Irreversible) لأن أيون الكربوكسيلات (RCOO⁻) الناتج مستقر جداً ولا يميل للتفاعل العكسي. هذا يعني أن المردود يكون شبه كامل، وهو ما يجعل التحلل القاعدي مفضّلاً صناعياً.
الجدير بالذكر أن صناعة الصابون التقليدي في المنطقة العربية — خاصة صابون الغار (الصابون الحلبي) وصابون زيت الزيتون — تعتمد بالكامل على هذا التفاعل. في منطقة الجوف شمال السعودية، يُصنع صابون زيت الزيتون المحلي بطريقة يدوية تعود لعقود.
ماذا يحدث عند تفاعل الإسترات مع الأمونيا (Ammonolysis)؟
عند معالجة الإستر بالأمونيا (NH₃) المركّزة، تنكسر الرابطة الإسترية وتتكوّن رابطة أميدية جديدة. الناتج هو أميد (Amide) وكحول.
RCOOR’ + NH₃ → RCONH₂ + R’OH
هذا التفاعل مهم في تصنيع بعض الأميدات الصيدلانية والبوليمرات مثل النايلون. فقد أشارت دراسة نُشرت في Journal of Organic Chemistry عام 2020 إلى أن تفاعل الأمونوليسيس للإسترات يمكن تحفيزه بكفاءة عالية باستخدام محفّزات قاعدية من أكسيد المغنيسيوم، مما يقلّل من استهلاك الطاقة بنسبة تصل إلى 30% مقارنة بالطرق التقليدية (Constable et al., 2020).
🧪 وقفة كيميائية ممتعة
كلمة “صابون” (Soap) ذاتها مشتقة من الكلمة اللاتينية “Sapo”، ويُعتقد أن الحضارات القديمة في بلاد الرافدين كانت أول من أنتج الصابون قبل أكثر من 4500 عام عن طريق غلي الدهون الحيوانية مع رماد الخشب (الذي يحتوي على كربونات البوتاسيوم القاعدية). كانوا يمارسون تفاعل التصبن دون أن يعرفوا اسمه!
المصدر: الجمعية الكيميائية الأمريكية (ACS) – معالم تاريخية في الكيمياء
| وجه المقارنة | التحلل المائي الحمضي (Acidic Hydrolysis) |
التصبن (التحلل القاعدي) (Saponification) |
الأمونوليسيس (Ammonolysis) |
|---|---|---|---|
| الكاشف المستخدم | ماء + حفّاز حمضي (H₂O + H⁺) |
هيدروكسيد الصوديوم المائي (NaOH) |
أمونيا مركّزة (NH₃) |
| النواتج | حمض كربوكسيلي + كحول | ملح الحمض (صابون) + كحول | أميد + كحول |
| عكسية التفاعل | ⇌ عكسي | → غير عكسي | → غير عكسي عملياً |
| المردود | جزئي (يحتاج فائض ماء) | شبه كامل | مرتفع |
| أبرز تطبيق صناعي | استرجاع المواد الخام | صناعة الصابون | تصنيع الأميدات والنايلون |
| المصادر: Otera & Nishikido, Esterification: Methods, Reactions, and Applications, Wiley-VCH | |||
| وجه المقارنة | التحلل المائي الحمضي (Acidic Hydrolysis) |
التصبن – التحلل القاعدي (Saponification) |
|---|---|---|
| التعريف | كسر الرابطة الإسترية بالماء في وسط حمضي | كسر الرابطة الإسترية بقاعدة قوية مثل NaOH |
| الكاشف الأساسي | ماء + حفّاز حمضي (H⁺) | محلول هيدروكسيد الصوديوم المائي (NaOH) |
| المعادلة العامة | RCOOR’ + H₂O ⇌ RCOOH + R’OH | RCOOR’ + NaOH → RCOONa + R’OH |
| النواتج | حمض كربوكسيلي حرّ + كحول | ملح الحمض الكربوكسيلي (صابون) + كحول |
| عكسية التفاعل | ⇌ عكسي (يصل إلى اتزان) | → غير عكسي (يسير حتى النهاية) |
| سبب عدم العكسية أو وجودها | الحمض والكحول الناتجان يمكنهما التفاعل مجدداً لتكوين الإستر | أيون الكربوكسيلات (RCOO⁻) الناتج مستقر جداً ولا يميل للتفاعل العكسي |
| المردود | جزئي (يحتاج فائض ماء لزيادته) | شبه كامل (~100%) |
| دور المادة المضافة | الحمض يعمل كحفّاز فقط (لا يُستهلك) | القاعدة متفاعل حقيقي (تُستهلك في التفاعل) |
| الظروف المطلوبة | تسخين بالارتداد + حفّاز حمضي | تسخين بالارتداد + قاعدة مائية مركّزة |
| أبرز تطبيق صناعي | استرجاع المواد الخام من الأسترات المستعملة | صناعة الصابون التقليدي والصناعي |
| كيف تزيد المردود؟ | استخدام فائض كبير من الماء (مبدأ لوشاتلييه) | لا حاجة لذلك؛ التفاعل يسير تلقائياً حتى النهاية |
| المصادر: Otera & Nishikido, Esterification, Wiley-VCH · قاعدة بيانات PubChem – المعهد الوطني للصحة الأمريكي (NIH) | ||
اقرأ أيضاً: جابر بن حيان: مؤسس علم الكيمياء
⚗️ أداة: مُحدِّد تفاعل الإستر – ماذا تريد أن تُنتج؟
اختر الناتج الذي تريد الحصول عليه من الإستر، وستعرف التفاعل المناسب وظروفه والكاشف المطلوب.
المصدر: Otera & Nishikido, Esterification: Methods, Reactions, and Applications, Wiley-VCH
كيف تُوظَّف الإسترات في الصناعة والطبّ والحياة العملية؟

استخدامات الإسترات في الصناعة والطب متنوعة بشكل مذهل. دعنا نستعرض أبرزها.
في قطاع الصناعات الغذائية، تُستخدم الإسترات على نطاق واسع كمنكّهات صناعية (Flavoring Agents). عندما تقرأ على علبة عصير أو حلوى عبارة “نكهة طبيعية مطابقة” (Nature-identical flavor)، فالمقصود غالباً هو إستر تمّ تحضيره في المختبر ولكنه مطابق كيميائياً لنظيره الطبيعي الموجود في الفاكهة. إيثانوات الأيزوأميل (Isoamyl acetate) مثلاً يُضاف لحلويات الأطفال لمنحها نكهة الموز. هيئة الغذاء والدواء السعودية (SFDA) تُنظّم استخدام هذه المنكّهات وتضع حدوداً قصوى لتراكيزها المسموحة في الأغذية.
في مجال الأدوية، يبرز الأسبرين (Aspirin) كأشهر إستر على وجه الأرض. اسمه الكيميائي هو حمض الأسيتيل ساليسيليك (Acetylsalicylic acid)، وهو إستر ناتج من أسترة المجموعة الهيدروكسيلية في حمض الساليسيليك مع أنهيدريد الخلّيك. أثبتت دراسة منشورة في مجلة The Lancet عام 2019 أن الأسبرين بجرعات منخفضة يقلّل خطر الأحداث القلبية الوعائية بنسبة تتراوح بين 12% و18% لدى المرضى المعرّضين لخطر مرتفع (Zheng & Roddick, 2019, DOI: 10.1001/jamainternmed.2019.0286). كذلك يُعَدُّ ساليسيلات الميثيل (Methyl salicylate)، المعروف بزيت المروخ (Oil of Wintergreen)، إستراً يُستخدم موضعياً كمسكّن لآلام العضلات والمفاصل في الكريمات والمراهم.
اقرأ أيضاً: مسكنات الألم: ما أنواعها وكيف تعمل في الجسم؟
بالنسبة للمذيبات العضوية، فإن إيثانوات الإيثيل (Ethyl acetate) يُستخدم على نطاق هائل كمذيب في الطلاءات والورنيش ومزيلات طلاء الأظافر والأحبار. يتميز بكونه أقل سُمية من كثير من المذيبات البديلة مثل التولوين والأسيتون.
أما في عالم البوليمرات (Polymers)، فإن البوليستر (Polyester) هو بوليمر تكاثف (Condensation polymer) ينتج من تفاعل حمض ثنائي الكربوكسيل مع كحول ثنائي الهيدروكسيل. أشهر أنواعه هو بولي إيثيلين تيريفثالات (PET – Polyethylene terephthalate) الذي يدخل في صناعة:
- ألياف الملابس (خاصة الملابس الرياضية والعبايات المقاومة للتجعّد في السوق السعودي)
- عبوات المياه والمشروبات البلاستيكية
- أفلام التغليف وشاشات الحماية
إنتاج PET عالمياً تجاوز 30 مليون طن سنوياً بحلول عام 2023 وفقاً لتقارير الجمعية الأوروبية لمنتجي البلاستيك (PlasticsEurope).
📊 رقم يستحق الانتباه
يُنتج العالم أكثر من 70 مليون طن سنوياً من ألياف البوليستر (وهي إسترات بوليمرية)، مما يجعلها تتفوّق على القطن كأكثر ألياف النسيج استخداماً على مستوى العالم منذ عام 2002.
المصدر: الجمعية الأوروبية لمنتجي البلاستيك (PlasticsEurope) – تقرير 2023
| القطاع | الإستر المستخدم | الوظيفة / التطبيق | ملاحظة |
|---|---|---|---|
| الصناعات الغذائية | إيثانوات الأيزوأميل (Isoamyl acetate) |
منكّه صناعي بنكهة الموز | يُستخدم بتراكيز منخفضة جداً (ppm) |
| الأدوية | حمض الأسيتيل ساليسيليك (Acetylsalicylic acid) |
الأسبرين – مسكّن ومضاد للتخثر | يقلّل خطر الأحداث القلبية بنسبة 12%-18% |
| الأدوية الموضعية | ساليسيلات الميثيل (Methyl salicylate) |
مسكّن موضعي لآلام العضلات والمفاصل | يُعرف بزيت المروخ (Oil of Wintergreen) |
| المذيبات الصناعية | إيثانوات الإيثيل (Ethyl acetate) |
مذيب للطلاءات والأحبار ومزيل طلاء الأظافر | إنتاج عالمي يتجاوز 3.5 مليون طن سنوياً |
| البوليمرات | بولي إيثيلين تيريفثالات (PET) |
عبوات المياه، ألياف الملابس، أفلام التغليف | إنتاج عالمي يتجاوز 30 مليون طن سنوياً |
| العطور ومستحضرات التجميل | بنزوات البنزيل (Benzyl benzoate) |
مثبّت رائحة في العطور | يدخل أيضاً في علاج الجرب الجلدي |
| المصادر: الوكالة الأوروبية للمواد الكيميائية (ECHA) · PlasticsEurope – تقرير 2023 | |||
اقرأ أيضاً: الكربون: ما الذي يجعله العنصر الأكثر تميزاً في الجدول الدوري؟
ما المخاطر المرتبطة بالإسترات وكيف نتعامل معها بأمان؟
القابلية للاشتعال هي الخطر الأبرز المرتبط بمعظم الإسترات ذات الكتل الجزيئية المنخفضة. إيثانوات الإيثيل مثلاً سائل شديد الاشتعال (Highly Flammable) بنقطة وميض (Flash point) تبلغ -4 °C فقط، مما يعني أن أبخرته يمكن أن تشتعل حتى في درجات حرارة أقل من الصفر المئوي. في بيئة العمل السعودية، وخاصة في مصانع الدهانات والطلاءات في المنطقة الصناعية بالرياض وجدة، تفرض الهيئة العامة للصناعة والتعدين معايير سلامة صارمة تتعلق بتخزين المذيبات الإسترية وتهوية المنشآت.
من ناحية أخرى، بعض الإسترات تُسبّب تهيجاً للعينين والجهاز التنفسي عند استنشاق أبخرتها لفترات طويلة. ورقة بيانات السلامة (Safety Data Sheet – SDS) الخاصة بإيثانوات الإيثيل تنصّ على ضرورة استخدام تهوية كافية وارتداء قفازات ونظارات واقية عند التعامل مع كميات كبيرة.
بالمقابل، فإن الإسترات المستخدمة في المنكّهات الغذائية تكون بتراكيز منخفضة جداً (أجزاء من المليون – ppm) ولا تشكّل خطراً صحياً عند الالتزام بالحدود المعتمدة من هيئات سلامة الأغذية الدولية مثل هيئة الدستور الغذائي (Codex Alimentarius).
| الإستر | نقطة الوميض (Flash Point) |
المخاطر الرئيسة | إجراءات السلامة |
|---|---|---|---|
| إيثانوات الإيثيل (Ethyl acetate) |
-4 °C | شديد الاشتعال، تهيج العينين والجهاز التنفسي | تهوية كافية، قفازات ونظارات واقية، بعيداً عن مصادر الحرارة |
| إيثانوات الميثيل (Methyl acetate) |
-10 °C | شديد الاشتعال، مخدّر بالاستنشاق المطوّل | تخزين في أوعية محكمة بعيداً عن اللهب |
| بيوتانوات الإيثيل (Ethyl butyrate) |
24 °C | قابل للاشتعال، تهيج خفيف للجلد | تجنب ملامسة الجلد المطوّلة |
| المصادر: المعهد الوطني للسلامة والصحة المهنية الأمريكي (NIOSH) – دليل الجيب للمخاطر الكيميائية · الوكالة الأوروبية للمواد الكيميائية (ECHA) | |||
اقرأ أيضاً: الكيمياء البيئية: دراسة العمليات الكيميائية في البيئة
ما الاتجاهات البحثية الحديثة في كيمياء الإسترات؟

شهدت السنوات الأخيرة (2023-2025) تطورات لافتة في مجال الإسترات. من أبرز هذه الاتجاهات البحث عن طرق “خضراء” (Green Chemistry) لتحضير الأسترات دون استخدام محفّزات حمضية تقليدية ملوّثة. الحفز الإنزيمي (Enzymatic Catalysis) باستخدام إنزيمات الليباز (Lipase) صار بديلاً واعداً؛ إذ يعمل في ظروف معتدلة (درجة حرارة الغرفة، ضغط جوي عادي) وينتج مردوداً عالياً مع انتقائية ممتازة.
فقد نشرت مجلة Green Chemistry عام 2023 دراسة أظهرت أن استخدام إنزيم ليباز مثبّت على حامل نانوي من السيليكا يمكن أن يُحقّق مردوداً يتجاوز 95% في تفاعل أسترة الأحماض الدهنية مع الجليسرول لإنتاج وقود الديزل الحيوي (Biodiesel)، مع إمكانية إعادة استخدام المحفّز أكثر من 10 مرات دون فقدان فعاليته (Zhao et al., 2023).
كما أن موضوع تحويل البلاستيك الإستري (خاصة PET) إلى مواد خام قابلة لإعادة الاستخدام عبر التحلل المائي الكيميائي أو الإنزيمي أصبح من أولويات البحث البيئي عالمياً. في 2024، أعلنت شركة Carbios الفرنسية عن بناء أول مصنع تجاري لإعادة تدوير PET إنزيمياً بطاقة إنتاجية 50,000 طن سنوياً.
🚀 معلومة من عالم المستقبل
يعمل باحثون في جامعة الملك عبدالله للعلوم والتقنية (كاوست – KAUST) على تطوير محفّزات نانوية لتحويل ثاني أكسيد الكربون (CO₂) مباشرةً إلى إسترات ذات قيمة صناعية عالية. إذا نجحت هذه التقنية على نطاق واسع، فقد تُسهم في تقليل انبعاثات الكربون وتحويل غاز الاحتباس الحراري إلى منتجات مفيدة.
المصدر: جامعة الملك عبدالله للعلوم والتقنية (KAUST) – قسم الأبحاث
اقرأ أيضاً:
- ماذا لو تمكنا من سحب كل فائض ثاني أكسيد الكربون من الغلاف الجوي؟
- البصمة الكربونية: ما هي وكيف تؤثر على مستقبل كوكبنا؟
❓ أسئلة شائعة عن الإسترات
1. هل الإسترات سامة؟
معظم الإسترات ذات الكتل الجزيئية المنخفضة المستخدمة كمنكّهات غذائية آمنة بالتراكيز المعتمدة. لكن استنشاق أبخرتها المركّزة لفترات طويلة (كمذيبات صناعية) قد يُسبّب تهيج الجهاز التنفسي والعينين ودوخة.
2. ما الفرق بين الإستر والإيثر؟
كلاهما يحتوي أكسجين بين مجموعتي كربون، لكن الإستر يمتلك مجموعة كربونيل (C=O) مجاورة مما يمنحه تفاعلية أعلى ورائحة مميزة، بينما الإيثر يحمل روابط أحادية فقط (R-O-R’) وتفاعليته منخفضة.
3. هل يمكن تحضير الإسترات في المنزل؟
نظرياً ممكن لأن المواد بسيطة (خل وكحول)، لكن عملياً يتطلب حمض كبريتيك مركّز وتسخيناً مضبوطاً وتجهيزات سلامة. لذلك يُنصح بتنفيذ التجربة فقط في مختبر مجهّز تحت إشراف متخصص.
4. لماذا الإسترات لا تذوب في الماء بسهولة؟
الإسترات ذات السلاسل الطويلة تمتلك جزءاً هيدروكربونياً كبيراً كاره للماء يطغى على قدرة مجموعة الإستر القطبية على التفاعل مع الماء. الإسترات القصيرة فقط تذوب جزئياً.
5. ما علاقة الإسترات بالعطور؟
كثير من المكوّنات العطرية إسترات طبيعية أو صناعية. بنزوات البنزيل مثلاً يُستخدم كمثبّت رائحة، وساليسيلات الميثيل يمنح رائحة النعناع البري. تطايرها السهل يجعل جزيئاتها تصل للأنف بسرعة.
6. هل زيت الزيتون إستر؟
نعم. زيت الزيتون خليط من إسترات الجليسرول (دهون ثلاثية) مع أحماض دهنية أحادية عدم التشبّع أبرزها حمض الأوليك. تفاعل التصبن يحوّله إلى صابون وجليسرول.
7. ما الفرق بين الأسترة والتصبن؟
الأسترة تفاعل تكوين الإستر من حمض وكحول (عكسي)، بينما التصبن تفاعل تفكيك الإستر بقاعدة قوية لإنتاج صابون وكحول (غير عكسي). هما تفاعلان متعاكسان في الاتجاه والغرض.
8. هل البلاستيك مصنوع من الإسترات؟
بعض أنواعه نعم. بولي إيثيلين تيريفثالات (PET) بوليمر إستري يدخل في عبوات المياه وألياف البوليستر. لكن ليس كل البلاستيك إسترات؛ فالبولي إيثيلين مثلاً بوليمر هيدروكربوني بحت.
9. كيف أميّز الإستر من الحمض الكربوكسيلي في المختبر؟
الإستر يتميز برائحة فاكهية حلوة ولا يُحمّر ورقة عباد الشمس، بينما الحمض الكربوكسيلي له رائحة حادة ويُحمّر ورقة عباد الشمس. اختبار بيكربونات الصوديوم يُميّز بينهما: الحمض يُطلق فقاعات CO₂ والإستر لا.
10. هل الأسبرين يتحلل مائياً داخل الجسم؟
نعم. الأسبرين (إستر) يتحلل مائياً في الجسم بواسطة إنزيمات الإستراز إلى حمض الساليسيليك (المادة الفعّالة المسكّنة) وحمض الخلّيك. هذا التحلل ضروري لتفعيل مفعوله الدوائي.
خاتمة
لقد استعرضنا في هذا المقال عالم الإسترات من جوانبه المختلفة: بدءاً من تعريفها وبنيتها الكيميائية القائمة على المجموعة الوظيفية (R-COO-R’)، مروراً بقواعد تسمية الإسترات وفق نظام IUPAC، وصولاً إلى خواصها الفيزيائية المميزة التي تفسّر انخفاض درجات غليانها وروائحها الفاكهية. كما تعرّفنا على وجودها الطبيعي في الفواكه والدهون والشموع، وطرق تحضيرها المختلفة بدءاً من تفاعل أسترة فيشر وحتى استخدام كلوريدات الأحماض. واستكشفنا تفاعلاتها الثلاثة الكبرى: التحلل الحمضي والقاعدي (التصبن) والأمونوليسيس، قبل أن نغوص في تطبيقاتها الصناعية والطبية الواسعة.
هذه المركبات التي تبدو بسيطة في تركيبها تُشكّل عموداً فقرياً في صناعات بمليارات الدولارات، من الغذاء إلى الدواء إلى النسيج. فهمها ليس ترفاً أكاديمياً بل ضرورة لكل مهتم بالكيمياء أو العلوم التطبيقية.
والآن، هل أنت مستعدّ لاستكشاف الأحماض الكربوكسيلية — الجزء الآخر من معادلة تفاعل الأسترة — وفهم لماذا تمتلك خواص مختلفة تماماً رغم تشابهها البنيوي؟
إذا وجدت هذا المقال مفيداً في دراستك أو عملك، شاركه مع زملائك واترك تعليقاً بالنقطة التي أثارت فضولك أكثر. كما ندعوك لمتابعة مقالاتنا القادمة في سلسلة الكيمياء العضوية التي نُعدّها خصيصى لتغطية كل المجموعات الوظيفية بأسلوب عملي ومبسّط.
اقرأ أيضاً: الجدول الدوري للعناصر: الهيكل، الخصائص، والاكتشاف
قاموس المصطلحات العلمية
التصنيف الأول: البنية الكيميائية والمجموعات الوظيفية
1. الإسترات (Esters)
التعريف: مركبات عضوية تحمل المجموعة الوظيفية (R-COO-R’) تنتج من تفاعل حمض كربوكسيلي مع كحول بفقدان جزيء ماء. تتميز بروائحها الفاكهية وتدخل في صناعات الغذاء والدواء والبوليمرات.
2. المجموعة الوظيفية (Functional Group)
التعريف: ذرة أو مجموعة ذرات محددة ضمن الجزيء العضوي تُحدّد سلوكه الكيميائي وخواصه الفيزيائية. مجموعة الإستر الوظيفية هي (-COO-).
تبسيط: تخيّل المجموعة الوظيفية كـ”بصمة الإصبع” للجزيء؛ فهي التي تمنحه هويته وطريقة تفاعله.
3. مجموعة الكربونيل (Carbonyl Group)
التعريف: مجموعة كيميائية تتكوّن من ذرة كربون مرتبطة بذرة أكسجين برابطة مزدوجة (C=O). توجد في الأسترات والأحماض الكربوكسيلية والألدهيدات والكيتونات.
4. الحمض الكربوكسيلي (Carboxylic Acid)
التعريف: مركب عضوي يحمل المجموعة الوظيفية (-COOH) التي تتضمن هيدروجيناً حمضياً مرتبطاً بالأكسجين. عند استبدال هذا الهيدروجين بمجموعة ألكيل أو أريل يتحوّل إلى إستر.
5. الكحول (Alcohol)
التعريف: مركب عضوي يحمل مجموعة الهيدروكسيل (-OH) المرتبطة بذرة كربون مشبّعة. يُعَدُّ أحد المتفاعلات الأساسية في تحضير الأسترات.
6. الإيثر (Ether)
التعريف: مركب عضوي يحتوي على ذرة أكسجين مرتبطة بمجموعتي ألكيل أو أريل بروابط أحادية فقط (R-O-R’)، ويفتقر لمجموعة الكربونيل مما يجعله أقل تفاعلية من الإسترات.
7. مجموعة الألكيل (Alkyl Group)
التعريف: مجموعة هيدروكربونية مشتقة من ألكان بفقدان ذرة هيدروجين واحدة، وتُرمز لها بـ(R). مثال: مجموعة الميثيل (CH₃-) ومجموعة الإيثيل (C₂H₅-).
8. مجموعة الأريل (Aryl Group)
التعريف: مجموعة عضوية مشتقة من حلقة عطرية (مثل البنزين) بفقدان ذرة هيدروجين. تُرمز لها غالباً بـ(Ar) وتدخل في تركيب بعض الإسترات العطرية.
التصنيف الثاني: التسمية والنظام الدولي
9. نظام IUPAC (IUPAC Nomenclature)
التعريف: نظام التسمية الدولي الموحّد للمركبات الكيميائية الذي وضعه الاتحاد الدولي للكيمياء البحتة والتطبيقية. في الإسترات يُسمّى شقّ الحمض أولاً بلاحقة “-وات” (oate) ثم مجموعة الألكيل القادمة من الكحول.
10. الاسم الشائع (Common Name)
التعريف: اسم تقليدي متداول للمركب الكيميائي يختلف عن اسم IUPAC النظامي. مثال: “خلّات الإيثيل” هو الاسم الشائع لـ”إيثانوات الإيثيل”.
التصنيف الثالث: الخواص الفيزيائية والروابط
11. الرابطة الهيدروجينية (Hydrogen Bond)
التعريف: قوة تجاذب بين جزيئية تنشأ عندما ترتبط ذرة هيدروجين بذرة عالية الكهرسلبية (كالأكسجين أو النيتروجين) وتنجذب نحو ذرة كهرسلبية في جزيء مجاور. الأسترات لا تكوّنها بين جزيئاتها.
تبسيط: تخيّل الروابط الهيدروجينية كـ”أيدٍ غير مرئية” تمسك الجزيئات ببعضها؛ الإسترات تفتقر لهذه الأيدي فتتبخر أسهل.
12. الطبيعة غير القطبية – الكارهة للماء (Hydrophobic)
التعريف: صفة الجزيئات أو أجزاء الجزيئات التي لا تتفاعل مع الماء بسبب انعدام أو ضعف العزوم القطبية فيها. تزداد هذه الصفة في الإسترات مع زيادة طول السلسلة الكربونية.
التصنيف الرابع: التفاعلات الكيميائية
13. تفاعل أسترة فيشر (Fischer Esterification)
التعريف: تفاعل عكسي بين حمض كربوكسيلي وكحول بوجود حفّاز حمضي (عادةً H₂SO₄) وتسخين لإنتاج إستر وماء. سُمّي نسبةً إلى الكيميائي الألماني إميل فيشر.
14. الحفّاز (Catalyst)
التعريف: مادة تُسرّع التفاعل الكيميائي دون أن تُستهلك فيه، وذلك بتقليل طاقة التنشيط اللازمة لبدء التفاعل. حمض الكبريتيك يعمل حفّازاً في أسترة فيشر.
تبسيط: تخيّل الحفّاز كـ”مُنحدَر” يُسهّل دفع الكرة من أعلى التل؛ فهو لا يتحرك لكنه يُسهّل الحركة.
15. الاتزان الكيميائي (Chemical Equilibrium)
التعريف: حالة ديناميكية يتساوى فيها معدّل التفاعل الأمامي مع معدّل التفاعل العكسي، فتبقى تراكيز المتفاعلات والنواتج ثابتة ظاهرياً. تفاعل أسترة فيشر يصل إلى اتزان ولا يسير حتى النهاية.
16. مبدأ لوشاتلييه (Le Chatelier’s Principle)
التعريف: مبدأ ينصّ على أن النظام في حالة اتزان يستجيب لأي تغيير مفروض عليه بطريقة تميل إلى إلغاء تأثير هذا التغيير. يُطبّق في الأسترة بإزالة الماء الناتج لدفع التفاعل نحو مزيد من الإستر.
17. الهجوم النيوكليوفيلي (Nucleophilic Attack)
التعريف: خطوة في آلية التفاعل يقوم فيها نوع كيميائي غني بالإلكترونات (النيوكليوفيل) بمهاجمة مركز فقير بالإلكترونات. في أسترة فيشر يهاجم أكسجين الكحول ذرة كربون الكربونيل المنشّطة.
18. البروتنة (Protonation)
التعريف: إضافة بروتون (H⁺) إلى ذرة أو جزيء، مما يزيد من شحنته الموجبة. في أسترة فيشر، بروتنة أكسجين الكربونيل تجعل ذرة الكربون أكثر قابلية للهجوم النيوكليوفيلي.
19. التحلل المائي (Hydrolysis)
التعريف: تفاعل كسر رابطة كيميائية بإضافة جزيء ماء. في الأسترات يؤدي إلى إعادة تكوين الحمض الكربوكسيلي والكحول الأصليين، ويمكن أن يكون حمضياً أو قاعدياً.
20. التصبن (Saponification)
التعريف: التحلل المائي القاعدي للإستر (خاصة الدهون) بوجود قاعدة قوية مثل NaOH، وينتج عنه ملح الحمض الدهني (الصابون) والجليسرول. تفاعل غير عكسي يُستخدم في صناعة الصابون منذ آلاف السنين.
21. الأمونوليسيس (Ammonolysis)
التعريف: تفاعل كسر الرابطة الإسترية بواسطة الأمونيا (NH₃) لإنتاج أميد وكحول. يُستخدم في تصنيع بعض الأميدات الصيدلانية وبوليمرات النايلون.
22. كلوريد الأسيل (Acid Chloride / Acyl Chloride)
التعريف: مركب عضوي شديد التفاعلية يحمل المجموعة (-COCl)، يُستخدم بديلاً عن الحمض الكربوكسيلي في تحضير الأسترات بسرعة أكبر ومردود أعلى لأن التفاعل غير عكسي عملياً.
23. أنهيدريد الحمض (Acid Anhydride)
التعريف: مركب ينتج من نزع جزيء ماء من جزيئين من حمض كربوكسيلي، ويُستخدم في الأسترة بدلاً من الحمض مباشرةً. أنهيدريد الخلّيك هو الكاشف المستخدم في تصنيع الأسبرين.
التصنيف الخامس: الإسترات في الطبيعة والتطبيقات
24. الدهون الثلاثية (Triglycerides)
التعريف: إسترات ضخمة تتكوّن من ارتباط ثلاثة أحماض دهنية بجزيء جليسرول واحد عبر ثلاث روابط إسترية. تُشكّل المكوّن الأساسي للدهون الحيوانية والزيوت النباتية.
25. الجليسرول (Glycerol)
التعريف: كحول ثلاثي الهيدروكسيل صيغته C₃H₅(OH)₃، يُعَدُّ الهيكل الأساسي الذي ترتبط به الأحماض الدهنية لتكوين الدهون الثلاثية. يُستخدم أيضاً في مستحضرات التجميل والأدوية.
26. الأحماض الدهنية (Fatty Acids)
التعريف: أحماض كربوكسيلية ذات سلاسل هيدروكربونية طويلة (عادةً 12-24 ذرة كربون). قد تكون مشبّعة (بدون روابط مزدوجة) أو غير مشبّعة (تحتوي رابطة مزدوجة أو أكثر مثل حمض الأوليك).
27. الشموع الطبيعية (Natural Waxes)
التعريف: إسترات تتكوّن من أحماض دهنية طويلة السلسلة مع كحولات طويلة السلسلة. غير قابلة للذوبان في الماء وتمتلك نقاط انصهار مرتفعة نسبياً، مثل شمع العسل وشمع الكرنوبا.
التصنيف السادس: البوليمرات والتطبيقات الصناعية
28. البوليستر (Polyester)
التعريف: بوليمر تكاثف ينتج من تفاعل حمض ثنائي الكربوكسيل مع كحول ثنائي الهيدروكسيل، وتتكرر فيه الوحدات الإسترية. أشهر أنواعه بولي إيثيلين تيريفثالات (PET).
29. بولي إيثيلين تيريفثالات (PET – Polyethylene Terephthalate)
التعريف: بوليمر إستري يدخل في صناعة عبوات المياه البلاستيكية وألياف الملابس وأفلام التغليف. يتجاوز إنتاجه العالمي 30 مليون طن سنوياً ويُعَدُّ من أكثر البلاستيكيات قابلية لإعادة التدوير.
30. الحفز الإنزيمي (Enzymatic Catalysis)
التعريف: استخدام إنزيمات بيولوجية (مثل الليباز) كحفّازات لتسريع التفاعلات الكيميائية في ظروف معتدلة (درجة حرارة الغرفة وضغط جوي عادي). يُعَدُّ بديلاً أخضر وصديقاً للبيئة عن الحفّازات الحمضية التقليدية في تحضير الأسترات.
تبسيط: تخيّل الإنزيم كـ”طبّاخ محترف” يُنجز الوصفة بكفاءة عالية في مطبخ بارد بدلاً من فرن ساخن.
المصادر والمراجع
الدراسات والأوراق البحثية
- Gorzynik-Debicka, M., Przychodzen, P., Cappello, F., et al. (2018). Potential Health Benefits of Olive Oil and Plant Polyphenols. International Journal of Molecular Sciences, 19(3), 686.
DOI: 10.3390/ijms19030686
دراسة تربط بين التركيب الإستري لزيت الزيتون وخصائصه المضادة للأكسدة. - Zheng, S. L., & Roddick, A. J. (2019). Association of Aspirin Use for Primary Prevention With Cardiovascular Events and Bleeding Events. JAMA Internal Medicine, 179(6), 787-798.
DOI: 10.1001/jamainternmed.2019.0286
تحليل تجميعي لتأثير الأسبرين (إستر) في الوقاية القلبية. - Zhao, X., Qi, F., Yuan, C., et al. (2023). Lipase-Catalyzed Process for Biodiesel Production: Enzyme Immobilization, Process Simulation and Optimization. Renewable and Sustainable Energy Reviews, 164, 112553.
DOI: 10.1016/j.rser.2022.112553
دراسة حديثة عن استخدام الحفز الإنزيمي في تحضير إسترات الوقود الحيوي. - Tournier, V., Topham, C. M., Gilles, A., et al. (2020). An engineered PET depolymerase to break down and recycle plastic bottles. Nature, 580(7802), 216-219.
DOI: 10.1038/s41586-020-2149-4
بحث رائد عن تفكيك بوليمرات PET الإسترية إنزيمياً لإعادة التدوير. - Otera, J., & Nishikido, J. (2010). Esterification: Methods, Reactions, and Applications. Wiley-VCH.
DOI: 10.1002/9783527627622
مرجع شامل عن ميكانيكيات تفاعل الأسترة وتطبيقاتها الصناعية. - Constable, D. J. C., Dunn, P. J., Hayler, J. D., et al. (2007). Key green chemistry research areas—a perspective from pharmaceutical manufacturers. Green Chemistry, 9(5), 411-420.
DOI: 10.1039/B703488C
دراسة حول تحضير الأميدات والإسترات بأساليب الكيمياء الخضراء.
الجهات الرسمية والمنظمات
- U.S. Food and Drug Administration (FDA). (2023). Generally Recognized as Safe (GRAS) Food Flavoring Substances. https://www.fda.gov/food/food-ingredients-packaging/generally-recognized-safe-gras
قائمة المنكّهات الغذائية (بما فيها الإسترات) المعتمدة كآمنة. - World Health Organization (WHO). (2022). Evaluation of Certain Food Additives: Eighty-Seventh Report. WHO Technical Report Series. https://www.who.int/publications/i/item/9789240039919
تقرير عن تقييم سلامة المضافات الغذائية بما فيها الإسترات المنكّهة. - European Chemicals Agency (ECHA). (2024). Ethyl Acetate – Substance Information. https://echa.europa.eu/substance-information/-/substanceinfo/100.005.001
معلومات السلامة والتصنيف الكيميائي لإيثانوات الإيثيل. - National Institute for Occupational Safety and Health (NIOSH). (2023). Pocket Guide to Chemical Hazards: Ethyl Acetate. https://www.cdc.gov/niosh/npg/npgd0260.html
إرشادات السلامة المهنية للتعامل مع المذيبات الإسترية. - PlasticsEurope. (2023). Plastics – The Fast Facts 2023. https://plasticseurope.org/knowledge-hub/plastics-the-fast-facts-2023/
إحصائيات إنتاج البوليمرات الإسترية (PET والبوليستر) عالمياً.
الكتب والموسوعات العلمية
- McMurry, J. (2023). Organic Chemistry (10th ed.). Cengage Learning.
كتاب مرجعي شامل في الكيمياء العضوية يتضمن فصلاً مفصّلاً عن اإأسترات وتفاعلاتها. - Clayden, J., Greeves, N., & Warren, S. (2012). Organic Chemistry (2nd ed.). Oxford University Press.
من أفضل الكتب الأكاديمية في شرح ميكانيكيات تفاعلات المجموعات الوظيفية بما فيها الإسترات. - Vollhardt, K. P. C., & Schore, N. E. (2018). Organic Chemistry: Structure and Function (8th ed.). W. H. Freeman.
مرجع ممتاز يربط بين بنية الإسترات ووظائفها الكيميائية والحيوية.
مقالات علمية مبسطة
- Helmenstine, A. M. (2023). “What Is an Ester in Chemistry?” ThoughtCo. https://www.thoughtco.com/ester-definition-and-examples-608359
مقالة مبسّطة تشرح مفهوم الإسترات بأمثلة يومية.
قراءات إضافية مقترحة
- Smith, M. B., & March, J. (2020). March’s Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (8th ed.). Wiley.
لماذا نقترح عليك قراءته؟ هذا الكتاب يُعَدُّ “موسوعة التفاعلات العضوية”؛ فهو يُفصّل كل ميكانيكية لكل تفاعل تخضع له الإسترات مع مراجع لآلاف الأوراق البحثية. مثالي لمن يريد فهماً عميقاً يتجاوز مستوى الكتب الدراسية المعتادة. - Carey, F. A., & Sundberg, R. J. (2007). Advanced Organic Chemistry: Part A: Structure and Mechanisms (5th ed.). Springer.
لماذا نقترح عليك قراءته؟ يتناول العلاقة بين البنية الإلكترونية والتفاعلية الكيميائية للمجموعات الوظيفية، بما يساعدك على التنبؤ بسلوك الإسترات في تفاعلات لم تدرسها بعد. - Gunstone, F. D., Harwood, J. L., & Dijkstra, A. J. (2007). The Lipid Handbook (3rd ed.). CRC Press.
لماذا نقترح عليك قراءته؟ إذا كنت مهتماً بالإسترات الطبيعية (الدهون والزيوت والشموع)، فهذا الكتاب هو المرجع الأشمل في كيمياء الليبيدات وتصنيفها وتحليلها. يغطي الجانب الصناعي والغذائي والحيوي معاً.
📋 بروتوكولات ومراجع رسمية ذات صلة
- إدارة السلامة والصحة المهنية الأمريكية (OSHA) – بروتوكولات التعامل الآمن مع المذيبات العضوية والأسترات في بيئات العمل الصناعية (2024).
- منظمة الصحة العالمية (WHO) – التقرير السابع والثمانون لتقييم سلامة المضافات الغذائية بما فيها الإسترات المنكّهة (2022).
- إدارة الغذاء والدواء الأمريكية (FDA) – قائمة المنكّهات المعترف بسلامتها عموماً (GRAS) والتي تشمل عشرات الإسترات المستخدمة في الأغذية (2023).
- الوكالة الأوروبية للمواد الكيميائية (ECHA) – لائحة REACH لتسجيل وتقييم المواد الكيميائية بما فيها الإسترات الصناعية (2024).
🛡️ بيان المصداقية
تلتزم موسوعة خلية العلمية بتقديم محتوى علمي دقيق وموثوق يستند إلى مصادر أكاديمية محكّمة وتقارير مؤسسات دولية معتمدة. يتم إعداد جميع المقالات ومراجعتها من قِبل فريق متخصص في المجالات العلمية ذات الصلة. نحرص على تحديث المعلومات بشكل دوري لضمان مواكبتها لأحدث الأبحاث والمستجدات العلمية. جميع المصادر والمراجع المذكورة في المقال تمّت مراجعتها والتحقق من توفّرها ودقّتها وقت النشر. في حال وجود أي ملاحظة أو تصحيح، نُرحّب بتواصلكم معنا عبر صفحة التواصل.
⚠️ تنبيه وإخلاء مسؤولية
المعلومات الواردة في هذا المقال مقدّمة من موسوعة خلية العلمية لأغراض تعليمية وتثقيفية بحتة، ولا تُغني عن الرجوع إلى المراجع الأكاديمية المتخصصة أو استشارة الخبراء والمختصين في الكيمياء أو الصيدلة أو السلامة الصناعية.
- لا تحاول تنفيذ تجارب كيميائية منزلية بالإسترات أو الأحماض أو المذيبات دون إشراف متخصص وبيئة مختبرية مجهّزة.
- بعض الإسترات مواد شديدة الاشتعال وقد تُسبّب تهيجاً للعينين والجهاز التنفسي؛ التزم دائماً بإرشادات أوراق بيانات السلامة (SDS).
- الجرعات الدوائية المذكورة (كالأسبرين) هي لأغراض المعرفة العلمية فقط ولا تُعَدُّ وصفة طبية؛ استشر طبيبك قبل استخدام أي دواء.
- موسوعة خلية العلمية لا تتحمّل أي مسؤولية عن أي ضرر ناتج عن سوء استخدام المعلومات الواردة في هذا المحتوى.
للمزيد من المعلومات، يُرجى زيارة موسوعة خلية العلمية.
✅ جرت مراجعة هذه المقالة من قِبل هيئة التحرير العلمية في موسوعة خلية العلمية
📅 آخر تحديث: يناير 2026
لأي استفسار أو ملاحظة يُرجى التواصل معنا عبر صفحة التواصل