قابلية الذوبان: من المبادئ الأساسية إلى التطبيقات المتقدمة في العلوم
مقدمة: حجر الزاوية في الكيمياء والعلوم الطبيعية
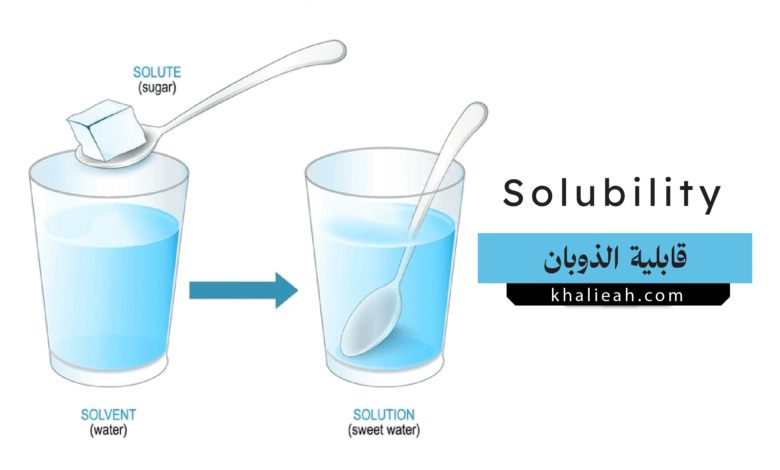
تُعد قابلية الذوبان (Solubility) واحدة من الخواص الفيزيائية والكيميائية الأساسية للمادة، والتي تشكل حجر الزاوية في فهم عدد لا يحصى من الظواهر الطبيعية والعمليات الصناعية. ببساطة، تعرف قابلية الذوبان بأنها أقصى كمية من مادة معينة (تسمى المذاب – Solute) يمكن أن تذوب في كمية معينة من مادة أخرى (تسمى المذيب – Solvent) عند درجة حرارة وضغط محددين لتكوين محلول متجانس (Homogeneous Solution). إن هذا المفهوم، على بساطته الظاهرية، يفتح الباب أمام عالم معقد من التفاعلات الجزيئية والقوى بين الجزيئية التي تحكم سلوك المواد. من تحضير فنجان القهوة في الصباح، إلى تصميم الأدوية المنقذة للحياة، وصولاً إلى فهم الدورات الجيوكيميائية في كوكبنا، تلعب قابلية الذوبان دوراً محورياً لا يمكن إغفاله. تهدف هذه المقالة إلى استكشاف مفهوم قابلية الذوبان بعمق أكاديمي، متناولةً أسسها النظرية، العوامل المؤثرة عليها، طرق قياسها، وتطبيقاتها الواسعة في مختلف المجالات العلمية والتكنولوجية، مع التركيز على إظهار كيف أن التحكم في قابلية الذوبان وفهمها يمثلان مفتاحاً للابتكار والتقدم.
المفهوم الأساسي لقابلية الذوبان: التوازن الديناميكي على المستوى الجزيئي
لفهم قابلية الذوبان بشكل دقيق، يجب النظر إليها على أنها عملية توازن ديناميكي (Dynamic Equilibrium) وليست حدثاً ساكناً. عندما يتم وضع مادة مذابة، مثل ملح الطعام (كلوريد الصوديوم)، في مذيب، مثل الماء، تبدأ عمليتان متزامنتان ومتعاكستان: عملية الذوبان (Dissolution) وعملية الترسيب (Precipitation) أو التبلور (Crystallization).
- عملية الذوبان: تتضمن هذه العملية تفكك الروابط بين جزيئات أو أيونات المذاب (قوى التجاذب بين المذاب والمذاب)، وتفكك الروابط بين جزيئات المذيب (قوى التجاذب بين المذيب والمذيب)، ومن ثم تكوين روابط جديدة بين جزيئات المذاب والمذيب (قوى التجاذب بين المذاب والمذيب). في حالة كلوريد الصوديوم في الماء، تقوم جزيئات الماء القطبية بإحاطة أيونات الصوديوم الموجبة وأيونات الكلوريد السالبة، وتكوين ما يسمى بـ “أغلفة التميه” (Hydration Shells)، مما يؤدي إلى فصل الأيونات عن الشبكة البلورية وإبقائها منتشرة في المحلول.
- عملية الترسيب: في الوقت نفسه، تتحرك الأيونات المذابة بشكل عشوائي في المحلول، وقد تتصادم مع بعضها البعض ومع سطح المادة الصلبة غير المذابة، لتعود وتترسب مرة أخرى في الشبكة البلورية.
عندما يكون معدل عملية الذوبان أكبر من معدل عملية الترسيب، يستمر المذاب في الذوبان. ولكن مع زيادة تركيز المذاب في المحلول، يزداد معدل الترسيب. في النهاية، يتم الوصول إلى نقطة يصبح فيها معدل الذوبان مساوياً تماماً لمعدل الترسيب. عند هذه النقطة، يقال إن المحلول “مشبع” (Saturated)، والتركيز عند هذا التوازن هو ما يحدد قابلية الذوبان للمادة في ذلك المذيب وعند تلك الظروف. أي كمية إضافية من المذاب لن تذوب، بل ستبقى كراسب. وبالتالي، فإن قابلية الذوبان ليست مجرد رقم ثابت، بل هي تعبير عن حالة توازن.
أنواع قابلية الذوبان
يمكن تصنيف قابلية الذوبان بناءً على الحالة الفيزيائية للمذاب والمذيب، حيث يظهر كل نوع سلوكاً مميزاً.
1. قابلية ذوبان المواد الصلبة في السوائل:
هذا هو النوع الأكثر شيوعاً ودراسة. تعتمد قابلية الذوبان للمادة الصلبة في السائل بشكل كبير على مبدأ “المتشابهات تذيب المتشابهات” (Like Dissolves Like). المواد القطبية (Polar) أو الأيونية (Ionic)، مثل السكر والملح، تظهر قابلية ذوبان عالية في المذيبات القطبية مثل الماء، بسبب قدرة جزيئات الماء على تكوين روابط هيدروجينية أو تفاعلات أيون-ثنائي القطب قوية مع المذاب. في المقابل، المواد غير القطبية (Non-polar)، مثل الشحوم والزيوت، تظهر قابلية ذوبان ضعيفة جداً في الماء، لكنها تذوب بسهولة في المذيبات غير القطبية مثل الهكسان أو رابع كلوريد الكربون.
2. قابلية ذوبان السوائل في السوائل:
عند خلط سائلين، يمكن أن يكونا “قابلين للامتزاج” (Miscible)، أي يذوبان في بعضهما البعض بأي نسبة، مثل الإيثانول والماء. أو يمكن أن يكونا “غير قابلين للامتزاج” (Immiscible)، مثل الزيت والماء، حيث يشكلان طبقتين منفصلتين. وهناك حالة وسطية، وهي “الامتزاج الجزئي” (Partially Miscible)، حيث تكون قابلية الذوبان محدودة، مثل الفينول في الماء. مرة أخرى، يلعب مبدأ “المتشابهات تذيب المتشابهات” دوراً حاسماً هنا؛ فالكحول والماء كلاهما قطبي ويحتويان على روابط هيدروجينية، مما يفسر امتزاجهما التام.
3. قابلية ذوبان الغازات في السوائل:
تختلف قابلية الذوبان للغازات في السوائل عن الحالات الأخرى. على عكس معظم المواد الصلبة، فإن قابلية الذوبان لجميع الغازات تقريباً في السوائل تتناقص مع زيادة درجة الحرارة. هذا هو السبب في أن المشروبات الغازية تفقد فورانها بسرعة عندما تكون دافئة؛ حيث تقل قابلية الذوبان لغاز ثاني أكسيد الكربون. كما تتأثر قابلية الذوبان للغازات بشكل كبير بالضغط، وهو ما يصفه قانون هنري (Henry’s Law).
العوامل المؤثرة على قابلية الذوبان
تعتبر قابلية الذوبان خاصية حساسة تعتمد على عدة عوامل متداخلة. فهم هذه العوامل ضروري للتحكم في العمليات الكيميائية وتفسير الظواهر الطبيعية.
1. طبيعة المذاب والمذيب:
كما ذكرنا، هذا هو العامل الأساسي. تعتمد القوى بين الجزيئية (Intermolecular Forces) على التركيب الكيميائي والقطبية. قابلية الذوبان تكون أعظم ما يمكن عندما تكون القوى بين جزيئات المذاب والمذيب مشابهة في النوع والقوة للقوى الموجودة داخل كل من المذاب والمذيب على حدة. تشمل هذه القوى: الروابط الهيدروجينية (Hydrogen Bonding)، تفاعلات ثنائي القطب-ثنائي القطب (Dipole-Dipole Interactions)، وقوى لندن التشتتية (London Dispersion Forces). إن التنبؤ الدقيق بقيم قابلية الذوبان بناءً على التركيب الجزيئي وحده لا يزال تحدياً كبيراً في الكيمياء الحاسوبية.
2. درجة الحرارة (Temperature):
تأثير درجة الحرارة على قابلية الذوبان يعتمد على التغير في المحتوى الحراري (Enthalpy Change, ΔH) لعملية الذوبان.
- للمواد الصلبة: إذا كانت عملية الذوبان ماصة للحرارة (Endothermic, ΔH > 0)، فإن قابلية الذوبان تزداد مع زيادة درجة الحرارة، وفقاً لمبدأ لوشاتلييه (Le Chatelier’s Principle). هذا هو الحال بالنسبة لمعظم الأملاح مثل نترات البوتاسيوم. أما إذا كانت العملية طاردة للحرارة (Exothermic, ΔH < 0)، فإن قابلية الذوبان تتناقص مع زيادة درجة الحرارة، كما في حالة كبريتات السيريوم (Ce₂(SO₄)₃).
- للغازات: عملية ذوبان الغازات في السوائل هي دائماً عملية طاردة للحرارة، حيث يتحول الغاز من حالة فوضوية إلى حالة أكثر تنظيماً في المحلول. لذلك، فإن قابلية الذوبان للغازات تقل دائماً مع ارتفاع درجة الحرارة.
3. الضغط (Pressure):
- للمواد الصلبة والسائلة: تأثير الضغط على قابلية الذوبان للمواد الصلبة والسائلة في المذيبات السائلة يكون ضئيلاً جداً ويمكن إهماله في معظم الحالات العملية، لأن هذه المواد غير قابلة للانضغاط بشكل كبير.
- للغازات: تأثير الضغط هائل. ينص قانون هنري على أن قابلية الذوبان لغاز في سائل تتناسب طردياً مع الضغط الجزئي (Partial Pressure) لذلك الغاز فوق سطح السائل عند درجة حرارة ثابتة. هذا هو المبدأ الذي تعمل به المشروبات الغازية، حيث يتم تعبئتها تحت ضغط عالٍ من ثاني أكسيد الكربون لزيادة قابلية الذوبان، وعند فتح العبوة، ينخفض الضغط فتقل قابلية الذوبان ويتحرر الغاز على شكل فقاعات.
4. تأثير الأيون المشترك (Common Ion Effect):
بالنسبة للمركبات الأيونية شحيحة الذوبان، فإن قابلية الذوبان تتأثر بوجود أيون مشترك في المحلول. على سبيل المثال، قابلية الذوبان لكلوريد الفضة (AgCl) في الماء النقي منخفضة. إذا تمت إضافة محلول يحتوي على أيون مشترك، مثل كلوريد الصوديوم (NaCl) الذي يوفر أيون Cl⁻، فإن توازن الذوبان (AgCl(s) ⇌ Ag⁺(aq) + Cl⁻(aq)) سينزاح نحو اليسار (نحو المتفاعلات) لتقليل تركيز أيون الكلوريد، مما يؤدي إلى انخفاض ملحوظ في قابلية الذوبان لكلوريد الفضة.
5. درجة الحموضة (pH):
تؤثر درجة الحموضة بشكل كبير على قابلية الذوبان للمواد التي لها خصائص حمضية أو قاعدية. على سبيل المثال، هيدروكسيدات الفلزات مثل هيدروكسيد المغنيسيوم (Mg(OH)₂) شحيحة الذوبان في الماء، لكن قابلية الذوبان لها تزداد بشكل كبير في المحاليل الحمضية، لأن أيونات الهيدروجين (H⁺) تتفاعل مع أيونات الهيدروكسيد (OH⁻) لتكوين الماء، مما يزيح توازن الذوبان نحو اليمين. وبالمثل، تزداد قابلية الذوبان للأملاح المشتقة من أحماض ضعيفة، مثل كربونات الكالسيوم (CaCO₃)، في المحاليل الحمضية.
التعبير الكمي عن قابلية الذوبان
يمكن التعبير عن قابلية الذوبان كمياً بعدة طرق، ويعتمد الاختيار على السياق العلمي أو الصناعي.
- الكتلة لكل حجم (Mass per Volume): وهي الطريقة الأكثر مباشرة، وتُعبر عنها بوحدات مثل جرام لكل 100 مليلتر (g/100 mL) أو جرام لكل لتر (g/L).
- المولارية (Molarity): تُعبر عن تركيز المحلول المشبع بعدد مولات المذاب لكل لتر من المحلول (mol/L). هذه الوحدة مفيدة جداً في حسابات التفاعلات الكيميائية.
- المولالية (Molality): تُعبر عن عدد مولات المذاب لكل كيلوجرام من المذيب (mol/kg). تتميز بأنها لا تتأثر بتغير درجة الحرارة، على عكس المولارية.
- ثابت حاصل الذوبان (Solubility Product Constant, Ksp): للمركبات الأيونية شحيحة الذوبان، يعتبر Ksp مقياساً مهماً. هو حاصل ضرب تراكيز الأيونات في المحلول المشبع، كل منها مرفوع إلى أسه الذي يساوي معامله في معادلة التوازن. كلما كانت قيمة Ksp أصغر، كانت قابلية الذوبان للمركب أقل. يوفر Ksp طريقة دقيقة لحساب قابلية الذوبان المولارية للملح.
منحنيات قابلية الذوبان وأهميتها
منحنى قابلية الذوبان هو رسم بياني يوضح العلاقة بين قابلية الذوبان لمادة ما (عادة على المحور الرأسي) ودرجة الحرارة (على المحور الأفقي). هذه المنحنيات أدوات قيمة للغاية في الكيمياء، وتوفر معلومات غنية:
- تحديد حالة المحلول: أي نقطة تقع على المنحنى تمثل محلولاً مشبعاً. أي نقطة أسفل المنحنى تمثل محلولاً غير مشبع (Unsaturated)، وأي نقطة فوق المنحنى تمثل محلولاً فوق مشبع (Supersaturated)، وهو حالة غير مستقرة يمكن أن تؤدي إلى التبلور السريع.
- التنبؤ بالتبلور: يمكن استخدام المنحنيات لتحديد كمية المادة التي ستتبلور عند تبريد محلول مشبع من درجة حرارة معينة إلى درجة حرارة أخرى. هذه هي أساس عملية التبلور التجزيئي (Fractional Crystallization) المستخدمة في تنقية المواد.
- مقارنة سلوك المواد: تسمح المنحنيات بمقارنة كيفية تغير قابلية الذوبان لمواد مختلفة مع درجة الحرارة. على سبيل المثال، يوضح المنحنى أن قابلية الذوبان لنترات البوتاسيوم تزداد بشكل حاد مع الحرارة، بينما تتغير قابلية الذوبان لكلوريد الصوديوم بشكل طفيف فقط.
التطبيقات العملية لقابلية الذوبان
إن فهم قابلية الذوبان والتحكم فيها ليس مجرد تمرين أكاديمي، بل له تطبيقات عملية واسعة تمس كل جانب من جوانب حياتنا.
1. الصناعات الدوائية:
تعتبر قابلية الذوبان للمركب الدوائي عاملاً حاسماً في فعاليته البيولوجية وتوافره الحيوي (Bioavailability). يجب أن يكون الدواء قابلاً للذوبان بدرجة كافية في سوائل الجسم ليتم امتصاصه في مجرى الدم ويصل إلى هدفه. العديد من المركبات الدوائية الجديدة الواعدة تظهر قابلية ذوبان ضعيفة في الماء، مما يمثل تحدياً كبيراً. يعمل العلماء على تطوير تقنيات لتعزيز قابلية الذوبان، مثل تكوين الأملاح، أو استخدام الجسيمات النانوية، أو تركيبات الأملاح الصلبة غير المتبلورة.
2. العلوم البيئية:
تلعب قابلية الذوبان دوراً حيوياً في مصير الملوثات في البيئة. قابلية الذوبان للمبيدات الحشرية أو الملوثات الصناعية في الماء تحدد مدى انتشارها في المياه الجوفية والأنهار. كما أن قابلية الذوبان لغازات مثل ثاني أكسيد الكربون في مياه المحيطات هي عملية رئيسية في دورة الكربون العالمية وتؤثر على تحمض المحيطات.
3. العمليات الصناعية:
تعتمد العديد من العمليات الصناعية على مبادئ قابلية الذوبان. عمليات مثل الاستخلاص (Extraction)، والتبلور (Crystallization)، والترسيب (Precipitation) تستخدم للاستفادة من الاختلافات في قابلية الذوبان لفصل وتنقية المنتجات الكيميائية. على سبيل المثال، في صناعة السكر، يتم استخلاص السكروز من قصب السكر باستخدام الماء الساخن لزيادة قابلية الذوبان، ثم يتم تبريد المحلول لتبلور السكر النقي.
4. الجيولوجيا وعلم المعادن:
تتحكم قابلية الذوبان للمعادن في المياه الجوفية على مدى فترات زمنية جيولوجية في تكوين التضاريس الكارستية (Karst Topography)، مثل الكهوف والصواعد والهوابط، والتي تتشكل من خلال الذوبان البطيء لكربونات الكالسيوم. كما أن ترسب المعادن من المحاليل المائية الحارة هو المسؤول عن تكوين العديد من الرواسب المعدنية القيمة. إن فهم قابلية الذوبان في ظل ظروف الضغط ودرجة الحرارة المرتفعة أمر بالغ الأهمية لعلماء الجيولوجيا.
تحديات وقياسات قابلية الذوبان في البحث العلمي
على الرغم من أن المفهوم يبدو بسيطاً، إلا أن القياس الدقيق والتنبؤ بقيم قابلية الذوبان يمثلان تحدياً مستمراً. تتطلب القياسات التجريبية الدقيقة وقتاً طويلاً للوصول إلى حالة التوازن الحقيقية، خاصة للمركبات شحيحة الذوبان. تستخدم تقنيات حديثة مثل كروماتوغرافيا السائل عالية الأداء (HPLC) لتحديد تركيز المذاب بدقة. أما من الناحية النظرية، فإن تطوير نماذج حاسوبية يمكنها التنبؤ بدقة بقيم قابلية الذوبان بناءً على التركيب الجزيئي فقط هو أحد الأهداف الرئيسية في الكيمياء النظرية، حيث يتطلب ذلك محاكاة دقيقة للتفاعلات المعقدة بين المذاب والمذيب. لا يزال تحسين قابلية الذوبان للمركبات الجديدة يمثل مجال بحث نشطًا ومهمًا.
الخاتمة
في الختام، تتجلى قابلية الذوبان كمفهوم أساسي متعدد الأوجه، يمتد تأثيره من أبسط التفاعلات في حياتنا اليومية إلى أعقد العمليات في الصناعة والبيئة والبيولوجيا. إنها ليست مجرد خاصية ثابتة للمادة، بل هي نتيجة لتوازن دقيق للقوى بين الجزيئات، وتتأثر بشدة بالظروف المحيطة مثل درجة الحرارة والضغط والتركيب الكيميائي للوسط. من خلال دراسة العوامل التي تحكم قابلية الذوبان، تمكن العلماء والمهندسون من تصميم عمليات جديدة، وتطوير أدوية أكثر فعالية، وفهم الأنظمة الطبيعية بشكل أعمق. إن الأبحاث المستمرة لفهم وتعديل قابلية الذوبان تظل محورية للابتكار العلمي والتكنولوجي، مما يؤكد على أن هذا المفهوم سيظل في صميم الكيمياء والعلوم التطبيقية لسنوات قادمة. إن إتقان فهم قابلية الذوبان هو إتقان لجزء كبير من لغة الكيمياء نفسها.
الأسئلة الشائعة
1. ما هو الفرق الجوهري بين قابلية الذوبان ومعدل الذوبان؟
الإجابة: هذا تمييز دقيق ولكنه حاسم في الكيمياء. قابلية الذوبان (Solubility) هي خاصية توازن ديناميكي (thermodynamic property) وتصف أقصى كمية من المذاب يمكن أن تذوب في مذيب معين عند ظروف محددة لتكوين محلول مشبع. إنها تمثل حالة التوازن النهائية للنظام وتعبر عن “كم” سيذوب. أما معدل الذوبان (Rate of Dissolution)، فهو خاصية حركية (kinetic property) تصف “مدى سرعة” ذوبان المذاب للوصول إلى حالة التشبع. يمكن لمادة أن تكون ذات قابلية ذوبان عالية جداً ولكنها تذوب ببطء شديد (معدل ذوبان منخفض) بسبب عوامل مثل صغر مساحة السطح أو الحاجة إلى طاقة تنشيط عالية لتفكيك الشبكة البلورية. على سبيل المثال، يمكن لبلورة كبيرة من السكر أن تتمتع بنفس قابلية الذوبان النهائية لمسحوق السكر الناعم في الماء، لكن المسحوق سيذوب بمعدل أسرع بكثير بسبب مساحة سطحه الأكبر.
2. لماذا تقل قابلية الذوبان للغازات في السوائل مع زيادة درجة الحرارة، على عكس معظم المواد الصلبة؟
الإجابة: يعود هذا السلوك المتناقض إلى الديناميكا الحرارية لعملية الذوبان. عملية ذوبان الغاز في سائل هي عملية طاردة للحرارة (Exothermic) دائماً. وذلك لأن جزيئات الغاز تكون في حالة عالية من الفوضى (إنتروبي عالٍ)، وعندما تذوب في سائل، تصبح أكثر تنظيماً وتقيداً، مما يؤدي إلى انخفاض في الإنتروبي (ΔS < 0). ولكي تكون العملية تلقائية (ΔG < 0)، يجب أن يكون التغير في المحتوى الحراري (Enthalpy) سالباً (ΔH < 0)، أي يجب أن تنطلق طاقة. وفقاً لمبدأ لوشاتلييه، عند تسخين نظام في حالة توازن وهو طارد للحرارة، فإن النظام سيستجيب عن طريق إزاحة التوازن في الاتجاه الماص للحرارة لامتصاص الحرارة المضافة. في هذه الحالة، الاتجاه الماص للحرارة هو خروج الغاز من المحلول. لذلك، تقل قابلية الذوبان للغاز مع ارتفاع درجة الحرارة.
3. ما هو الأساس العلمي لمبدأ “المتشابهات تذيب المتشابهات” (Like Dissolves Like)؟
الإجابة: يكمن الأساس العلمي لهذا المبدأ في طبيعة القوى بين الجزيئية (Intermolecular Forces – IMFs). لكي تتم عملية الذوبان، يجب التغلب على قوى التجاذب بين جزيئات المذاب (مذاب-مذاب) وقوى التجاذب بين جزيئات المذيب (مذيب-مذيب)، واستبدالها بقوى تجاذب جديدة بين جزيئات المذاب والمذيب (مذاب-مذيب). تكون قابلية الذوبان مرتفعة عندما تكون قوى التجاذب الجديدة (مذاب-مذيب) قوية ومماثلة للقوى التي تم التغلب عليها.
- المذيبات القطبية (مثل الماء) لها جزيئات ذات نهايات موجبة وسالبة جزئية، مما يمكنها من تكوين روابط هيدروجينية وتفاعلات ثنائي القطب-ثنائي القطب قوية. لذلك، هي فعالة في إذابة المذابات القطبية أو الأيونية.
- المذيبات غير القطبية (مثل الهكسان) تعتمد على قوى لندن التشتتية الضعيفة. لذلك، هي فعالة في إذابة المذابات غير القطبية التي تتجاذب أيضاً عبر قوى لندن.
عند محاولة إذابة مذاب غير قطبي في مذيب قطبي، تكون قوى التجاذب بين المذيب القطبي ونفسه (مثل الروابط الهيدروجينية في الماء) أقوى بكثير من أي تجاذب يمكن أن يتكون مع المذاب غير القطبي. نتيجة لذلك، تفضل جزيئات المذيب البقاء متجاذبة مع بعضها البعض، مما يؤدي إلى انخفاض قابلية الذوبان.
4. كيف يمكن تحضير محلول فوق مشبع (Supersaturated)، ولماذا يعتبر حالة غير مستقرة؟
الإجابة: يتم تحضير محلول فوق مشبع عن طريق إذابة كمية من المذاب في مذيب ساخن تفوق قابلية الذوبان عند درجة حرارة الغرفة، ثم تبريد المحلول ببطء وحذر شديد. إذا تم التبريد دون اضطراب أو وجود أسطح للتبلور (مراكز تنوية)، فإن المذاب الزائد يبقى ذائباً مؤقتاً في المحلول، مما يخلق حالة فوق التشبع. يعتبر هذا المحلول حالة غير مستقرة ديناميكياً (Metastable State) لأنه يحتوي على مذاب بتركيز أعلى مما يسمح به توازن قابلية الذوبان عند درجة الحرارة المنخفضة. إنه مثل كرة تقف على قمة تل، لديها طاقة كامنة عالية وتحتاج فقط إلى دفعة صغيرة لتبدأ بالتدحرج إلى حالة أكثر استقراراً. أي اضطراب بسيط، مثل خدش جدار الوعاء أو إضافة بلورة صغيرة من المذاب (تسمى بلورة البذرة)، سيوفر مركزاً للتبلور، مما يؤدي إلى ترسيب سريع وفوري للمذاب الزائد حتى يصل المحلول إلى حالة التشبع المستقرة.
5. ما هي العلاقة بين ثابت حاصل الذوبان (Ksp) وقابلية الذوبان المولارية؟
الإجابة: ثابت حاصل الذوبان (Ksp) هو ثابت التوازن لتفاعل ذوبان مركب أيوني شحيح الذوبان في الماء. قابلية الذوبان المولارية (s) هي تركيز (بالمول/لتر) للمركب الذي يذوب في الماء لتكوين محلول مشبع. العلاقة بينهما تعتمد على الصيغة الكيميائية للمركب.
- لملح بسيط مثل كلوريد الفضة (AgCl)، الذي يتفكك إلى Ag⁺ و Cl⁻، فإن Ksp = [Ag⁺][Cl⁻]. بما أن تركيز كل أيون يساوي قابلية الذوبان المولارية (s)، فإن Ksp = (s)(s) = s².
- لملح مثل فلوريد الكالسيوم (CaF₂)، الذي يتفكك إلى Ca²⁺ و 2F⁻، فإن Ksp = [Ca²⁺][F⁻]². هنا، [Ca²⁺] = s و [F⁻] = 2s. لذلك، Ksp = (s)(2s)² = 4s³.
إذن، يمكن استخدام قيمة Ksp المنشورة لحساب قابلية الذوبان المولارية للملح، والعكس صحيح. هذه العلاقة مفيدة جداً للتنبؤ الكمي بمدى ذوبان المركبات شحيحة الذوبان وتحديد الظروف التي يحدث فيها الترسيب.
6. لماذا تعد قابلية الذوبان الضعيفة في الماء تحدياً كبيراً في مجال تطوير الأدوية؟
الإجابة: التوافر الحيوي (Bioavailability) للدواء، أي النسبة من الجرعة التي تصل إلى الدورة الدموية بشكل فعال، يعتمد بشكل حاسم على خطوتين: الذوبان والامتصاص. لكي يتم امتصاص الدواء عبر أغشية الجهاز الهضمي، يجب أن يكون أولاً في حالة ذائبة في السوائل المائية في المعدة والأمعاء. إذا كانت قابلية الذوبان للمركب الدوائي منخفضة جداً، فإنه لن يذوب بكمية كافية ليتم امتصاصه بفعالية، مما يؤدي إلى تركيزات منخفضة من الدواء في الدم وبالتالي فعالية علاجية ضعيفة أو غير متوقعة، حتى لو كان المركب قوياً جداً على المستوى الجزيئي. هذا يعني أن جزءاً كبيراً من الجرعة الدوائية قد يمر عبر الجسم دون أن يمارس أي تأثير. لذلك، يعمل العلماء على تحسين قابلية الذوبان من خلال استراتيجيات مثل تكوين الأملاح، تقليل حجم الجسيمات (Micronization)، أو استخدام أنظمة توصيل متقدمة.
7. كيف يفسر تأثير الأيون المشترك (Common Ion Effect) انخفاض قابلية الذوبان للمركبات الأيونية؟
الإجابة: تأثير الأيون المشترك هو تطبيق مباشر لمبدأ لوشاتلييه على توازنات الذوبان. لنأخذ مثال كبريتات الباريوم (BaSO₄)، وهو مركب شحيح الذوبان: BaSO₄(s) ⇌ Ba²⁺(aq) + SO₄²⁻(aq). في الماء النقي، تكون قابلية الذوبان محددة بقيمة Ksp. إذا تمت إضافة مصدر آخر لأحد الأيونات المكونة للملح، مثل كبريتات الصوديوم (Na₂SO₄) الذي يوفر أيون الكبريتات (SO₄²⁻)، فإن تركيز هذا الأيون “المشترك” في المحلول يزداد. وفقاً لمبدأ لوشاتلييه، سيستجيب نظام التوازن لهذا الإزعاج عن طريق إزاحة التوازن نحو اليسار، أي في اتجاه تكوين المزيد من الراسب الصلب (BaSO₄)، وذلك لتقليل تركيز أيون الكبريتات في المحلول. نتيجة لذلك، ينخفض تركيز أيون الباريوم (Ba²⁺) في المحلول المشبع، مما يعني أن قابلية الذوبان لكبريتات الباريوم تكون أقل في وجود أيون مشترك مقارنة بقيمتها في الماء النقي.
8. هل يمكن التنبؤ بقيم قابلية الذوبان بشكل دقيق باستخدام النماذج الحاسوبية فقط؟
الإجابة: التنبؤ الدقيق بقيم قابلية الذوبان من المبادئ الأولى (ab initio) باستخدام النماذج الحاسوبية فقط لا يزال أحد التحديات الكبرى في الكيمياء الحاسوبية. عملية الذوبان معقدة للغاية وتتضمن توازناً دقيقاً بين تغيرات الإنثالبي والإنتروبي لتفكك المذاب، وتفكك المذيب، وعملية التذاوب (Solvation). تتطلب النمذجة الدقيقة حسابات كمومية معقدة للقوى بين الجزيئية، وتأثيرات التذاوب الديناميكية، والتغيرات الهيكلية في المذيب حول المذاب. في حين أن هناك تقدماً كبيراً في تطوير نماذج مثل QSPR (Quantitative Structure-Property Relationship) التي تستخدم التعلم الآلي لربط البنية الجزيئية بالخواص، فإنها غالباً ما تكون تجريبية وتتطلب بيانات تدريبية كبيرة. لا تزال القياسات التجريبية هي المعيار الذهبي لتحديد قابلية الذوبان بدقة، بينما تعمل النماذج الحاسوبية كأدوات تنبؤية مفيدة في المراحل المبكرة من البحث، مثل فحص الأدوية.
9. كيف تؤثر درجة الحموضة (pH) على قابلية الذوبان لمركب مثل هيدروكسيد المغنيسيوم (Mg(OH)₂)، وهو مكون شائع في مضادات الحموضة؟
الإجابة: تؤثر درجة الحموضة بشكل كبير على قابلية الذوبان للمركبات التي تحتوي على أيونات حمضية أو قاعدية. هيدروكسيد المغنيسيوم هو قاعدة شحيحة الذوبان يتفكك وفقاً للتوازن: Mg(OH)₂(s) ⇌ Mg²⁺(aq) + 2OH⁻(aq). في وسط متعادل أو قاعدي، يكون تركيز أيونات الهيدروكسيد (OH⁻) مرتفعاً نسبياً، مما يبقي التوازن مزاحاً نحو اليسار، وتكون قابلية الذوبان منخفضة جداً. أما في وسط حمضي (مثل المعدة التي تحتوي على حمض الهيدروكلوريك HCl)، يكون هناك تركيز عالٍ من أيونات الهيدروجين (H⁺). تتفاعل هذه الأيونات بشكل فوري مع أيونات الهيدروكسيد (OH⁻) الناتجة عن الذوبان لتكوين الماء (H⁺ + OH⁻ → H₂O)، وهي عملية ذات ثابت توازن كبير جداً. هذا التفاعل يزيل أيونات الهيدروكسيد من المحلول، ووفقاً لمبدأ لوشاتلييه، فإن نظام توازن الذوبان سينزاح بقوة نحو اليمين لتعويض أيونات الهيدروكسيد المستهلكة. نتيجة لذلك، تزداد قابلية الذوبان لهيدروكسيد المغنيسيوم بشكل كبير في البيئة الحمضية للمعدة، مما يسمح له بالتفاعل وتحييد الحمض الزائد.
10. ما هو دور قابلية الذوبان في العمليات الجيولوجية مثل تكوين الكهوف؟
الإجابة: تلعب قابلية الذوبان دوراً محورياً في تشكيل التضاريس الجيولوجية على مدى فترات زمنية طويلة. تكوين الكهوف في المناطق الكارستية هو مثال كلاسيكي. تتكون هذه المناطق بشكل أساسي من صخور الحجر الجيري، التي تتكون من كربونات الكالسيوم (CaCO₃)، وهي مادة ذات قابلية ذوبان منخفضة جداً في الماء النقي. ومع ذلك، عندما يذوب ثاني أكسيد الكربون من الغلاف الجوي في مياه الأمطار، فإنه يشكل حمض الكربونيك الضعيف (H₂CO₃). هذا الحمض يتفاعل مع كربونات الكالسيوم غير القابلة للذوبان تقريباً ويحولها إلى بيكربونات الكالسيوم (Ca(HCO₃)₂)، التي تتمتع بقابلية ذوبان أعلى بكثير في الماء. على مدى آلاف السنين، تقوم هذه المياه الحمضية قليلاً بالتسرب عبر شقوق الصخور، وتذيب الحجر الجيري ببطء، مما يؤدي إلى توسيع الشقوق وتكوين أنظمة كهوف واسعة. لاحقاً، عندما تتسرب هذه المياه المشبعة بيكربونات الكالسيوم إلى داخل الكهف ويتسرب منها ثاني أكسيد الكربون، ينعكس التفاعل، وتترسب كربونات الكالسيوم مرة أخرى لتشكل الهوابط والصواعد.