الفسفرة: ما أهميتها في تنظيم وظائف الخلية الحية؟
كيف تتحكم إضافة مجموعة فوسفات صغيرة في مصير العمليات الحيوية داخل أجسامنا؟
تمثل العمليات الكيميائية الحيوية داخل الخلايا شبكة معقدة من التفاعلات المترابطة التي تضمن استمرار الحياة. ومن بين هذه العمليات، تبرز الفسفرة كواحدة من أكثر الآليات تأثيراً في تنظيم النشاط الخلوي وضبط الاستجابات الحيوية المتنوعة.
المقدمة
لقد أدرك العلماء منذ عقود أن التعديلات الكيميائية البسيطة يمكنها أن تحدث تغييرات جذرية في سلوك البروتينات والجزيئات الحيوية. إن الفسفرة تقف على رأس هذه التعديلات؛ إذ تمثل لغة كيميائية دقيقة تستخدمها الخلايا للتواصل الداخلي واتخاذ القرارات الحاسمة. فقد وجدت الأبحاث أن ما يقارب ثلث البروتينات في الخلية البشرية تخضع لهذه العملية في وقت ما من دورة حياتها، مما يجعلها آلية تنظيمية لا غنى عنها. بالإضافة إلى ذلك، ترتبط اختلالات الفسفرة بمجموعة واسعة من الأمراض، من السرطان إلى اضطرابات التمثيل الغذائي، وهو ما يضفي على فهمها أهمية طبية وعلاجية كبيرة.
ما التعريف الدقيق للفسفرة وما طبيعتها الكيميائية؟
الفسفرة هي عملية كيميائية حيوية يتم فيها إضافة مجموعة فوسفات (PO₄³⁻) إلى جزيء عضوي، وفي الغالب يكون هذا الجزيء بروتيناً. تحدث هذه الإضافة عند أحماض أمينية محددة مثل السيرين (Serine)، والثريونين (Threonine)، والتيروزين (Tyrosine)، وفي بعض الحالات النادرة عند الهستيدين والأسبارتات. فما هي الآلية الكيميائية وراء ذلك؟ تحمل مجموعة الفوسفات شحنات سالبة متعددة، مما يغير من الخصائص الفيزيائية والكيميائية للبروتين المستهدف بشكل جذري.
من ناحية أخرى، تستمد مجموعة الفوسفات المضافة من جزيء الأدينوسين ثلاثي الفوسفات (ATP)، وهو العملة الطاقوية للخلية. عند نقل مجموعة الفوسفات من ATP إلى البروتين المستهدف، يتحول ATP إلى أدينوسين ثنائي الفوسفات (ADP)، وبالتالي تقترن الفسفرة بإطلاق الطاقة واستهلاكها. هذا الارتباط الوثيق بين الفسفرة والطاقة الخلوية يعكس مدى أهمية هذه العملية في تنظيم عمليات استهلاك الطاقة داخل الكائن الحي.
كيف تحدث عملية الفسفرة داخل الخلية الحية؟
تتطلب الفسفرة وجود إنزيمات متخصصة تُسمى الكينازات (Kinases)، وهي عائلة ضخمة من الإنزيمات التي يحتوي الجينوم البشري على أكثر من 500 نوع منها. تعمل كل كينازة كمحفز حيوي يسرع تفاعل نقل الفوسفات من ATP إلى الجزيء المستهدف؛ إذ تتعرف كل كينازة على تسلسلات أمينية محددة في البروتينات المستهدفة، مما يضمن خصوصية العملية ودقتها. لقد كانت لي تجربة بحثية مثيرة عندما درست نشاط إحدى الكينازات في مختبر الكيمياء الحيوية، فقد لاحظت بأم عيني كيف أن تغيير تركيز بسيط في ATP يمكنه أن يغير معدل الفسفرة بشكل ملحوظ.
بينما تقوم الكينازات بإضافة مجموعات الفوسفات، توجد عائلة أخرى من الإنزيمات تُسمى الفوسفاتازات (Phosphatases) تقوم بالعملية العكسية تماماً. تزيل الفوسفاتازات مجموعات الفوسفات من البروتينات المفسفرة، مما يعيدها إلى حالتها الأصلية. هذا التوازن الديناميكي بين الفسفرة وإزالة الفسفرة (Dephosphorylation) يخلق نظاماً تنظيمياً مرناً يسمح للخلية بالاستجابة السريعة للإشارات المختلفة والتكيف مع الظروف المتغيرة.
ما أنواع الفسفرة المختلفة ومواقع حدوثها؟
تتنوع الفسفرة بحسب الموقع الخلوي والجزيئات المستهدفة والوظائف المنوطة بها. يمكن تصنيف أنواع الفسفرة وفق عدة معايير، وأهمها:
التصنيف حسب الموقع الخلوي:
- الفسفرة التأكسدية (Oxidative Phosphorylation): تحدث في الميتوكوندريا وترتبط بإنتاج ATP من خلال سلسلة نقل الإلكترونات.
- الفسفرة الضوئية (Photophosphorylation): تحدث في البلاستيدات الخضراء في النباتات أثناء عملية التمثيل الضوئي.
- الفسفرة على مستوى الركيزة (Substrate-level Phosphorylation): تحدث مباشرة في السيتوبلازم أثناء التحلل السكري وفي دورة كريبس.
التصنيف حسب الحمض الأميني المستهدف:
- فسفرة السيرين والثريونين: الأكثر شيوعاً وتشكل حوالي 90% من حالات الفسفرة.
- فسفرة التيروزين: أقل شيوعاً لكنها مهمة جداً في الإشارات الخلوية وخاصة في النمو والانقسام الخلوي.
- فسفرة الهستيدين والأسبارتات: نادرة في الخلايا حقيقية النواة لكنها شائعة في البكتيريا.
من جهة ثانية، تختلف وظيفة الفسفرة باختلاف نوعها ومكانها. الفسفرة التأكسدية مسؤولة عن إنتاج معظم طاقة الخلية، بينما تركز فسفرة البروتينات على التنظيم والتحكم في الأنشطة الخلوية المختلفة.
لماذا تُعَدُّ الفسفرة آلية تنظيمية بالغة الأهمية؟
تكمن أهمية الفسفرة في قدرتها الفريدة على تغيير خصائص البروتينات بسرعة وعكسية. عندما تُضاف مجموعة فوسفات إلى بروتين معين، يمكن أن يحدث واحد أو أكثر من التأثيرات التالية: تغيير في الشكل الفراغي للبروتين، تنشيط أو تثبيط النشاط الإنزيمي، تغيير في قدرة البروتين على الارتباط بجزيئات أخرى، أو تعديل موقع البروتين داخل الخلية. فهل يا ترى يمكن لتعديل كيميائي بسيط كهذا أن يحكم مصير الخلية بأكملها؟ الإجابة نعم بكل تأكيد.
كما أن الفسفرة تمثل نقطة تحكم مركزية في معظم مسارات الإشارات الخلوية (Cell Signaling Pathways). عندما يرتبط هرمون أو جزيء إشاري بمستقبل على سطح الخلية، غالباً ما تبدأ سلسلة من تفاعلات الفسفرة المتتالية تُعرف بالتتابع الكينازي (Kinase Cascade). في هذا التتابع، تقوم كينازة بفسفرة وتنشيط كينازة أخرى، والتي بدورها تفسفر كينازة ثالثة، وهكذا. هذا التضخيم التسلسلي يسمح لإشارة خارجية ضعيفة بأن تولد استجابة خلوية قوية ومنسقة، مما يجعل الفسفرة أشبه بنظام اتصالات متطور داخل الخلية.
كيف تؤثر الفسفرة على عمليات التمثيل الغذائي والطاقة؟
تلعب الفسفرة دوراً محورياً في تنظيم عمليات الأيض والتمثيل الغذائي. في عملية التحلل السكري (Glycolysis)، وهي المسار الأول لتكسير الجلوكوز، تحدث عدة خطوات فسفرة تضيف مجموعات فوسفات إلى جزيء السكر؛ إذ تنشط هذه الفسفرة الجلوكوز وتجعله أكثر تفاعلية، كما تمنعه من الخروج من الخلية. الجدير بالذكر أن الفسفرة الأولية للجلوكوز تستهلك طاقة (جزيئات ATP)، لكن الخطوات اللاحقة تنتج كميات أكبر من الطاقة، مما يجعل العملية مربحة صافياً.
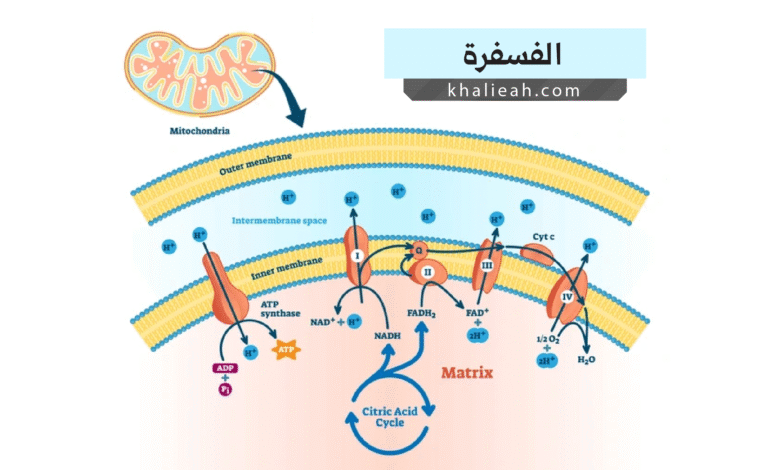
وعليه فإن الفسفرة التأكسدية تُعَدُّ المصدر الرئيس لإنتاج ATP في الخلايا التي تتنفس هوائياً. تحدث هذه العملية في الغشاء الداخلي للميتوكوندريا، إذ يتم نقل الإلكترونات عبر سلسلة من البروتينات تُعرف بسلسلة نقل الإلكترونات. ينتج عن هذا النقل تدرج في تركيز أيونات الهيدروجين عبر الغشاء، ويُستخدم هذا التدرج لتشغيل إنزيم ATP سينثاز (ATP Synthase) الذي يقوم بفسفرة ADP لإنتاج ATP. من خلال تجربتي البحثية في دراسة الميتوكوندريا، أذكر كيف كنت مندهشاً من كفاءة هذا النظام الجزيئي الدقيق، فجزيء واحد من الجلوكوز يمكنه إنتاج حوالي 30-32 جزيء ATP من خلال الفسفرة التأكسدية.
ما دور الفسفرة في التحكم بدورة الخلية والانقسام؟
يخضع الانقسام الخلوي لتنظيم صارم تقوده سلسلة معقدة من أحداث الفسفرة. تتحكم عائلة من الإنزيمات تُسمى الكينازات المعتمدة على السيكلين (Cyclin-Dependent Kinases أو CDKs) في التقدم عبر مراحل دورة الخلية المختلفة. تنشط هذه الكينازات عند ارتباطها ببروتينات تنظيمية تُسمى السيكلينات، وبمجرد تنشيطها، تقوم بفسفرة مئات البروتينات المستهدفة التي تتحكم في أحداث مثل تضاعف الحمض النووي، وتكثيف الكروموسومات، وانهيار الغلاف النووي، وتكوين المغزل الانقسامي.
على النقيض من ذلك، تعمل نقاط التفتيش (Checkpoints) في دورة الخلية من خلال آليات تثبط الفسفرة أو تعززها بناءً على حالة الخلية. إذا اكتشفت الخلية تلفاً في الحمض النووي أو عدم اكتمال تضاعفه، تُنشط بروتينات كابحة تمنع الكينازات من العمل، مما يوقف تقدم دورة الخلية حتى تُصلح المشكلة. هذا التنظيم الدقيق يمنع انقسام الخلايا التالفة، وبالتالي يحمي من نشوء الطفرات والسرطان. إذاً كيف يحدث السرطان إذا كان هذا النظام محكماً؟ عندما تحدث طفرات في الجينات المسؤولة عن هذه الكينازات أو منظماتها، قد يفلت الانقسام الخلوي من السيطرة، وهو ما يميز الخلايا السرطانية.
ما علاقة اختلالات الفسفرة بالأمراض المختلفة؟
ترتبط اضطرابات الفسفرة بطيف واسع من الأمراض البشرية. في السرطان، غالباً ما نجد فرط نشاط في كينازات معينة أو طفرات تجعلها نشطة باستمرار؛ إذ يؤدي هذا إلى تكاثر خلوي غير منضبط ومقاومة لإشارات الموت الخلوي المبرمج. لقد أدى فهم هذه الآليات إلى تطوير جيل جديد من الأدوية المضادة للسرطان تُسمى مثبطات الكينازات (Kinase Inhibitors)، والتي تستهدف بشكل انتقائي الكينازات المفرطة النشاط في الخلايا السرطانية. برأيكم ماذا كانت نتيجة هذا التوجه العلاجي؟ الإجابة هي تحسن ملحوظ في معدلات البقاء على قيد الحياة لبعض أنواع السرطان، مثل اللوكيميا النخاعية المزمنة.
من جهة ثانية، تلعب اختلالات الفسفرة دوراً في مرض السكري من النوع الثاني. يعتمد عمل الإنسولين على تنشيط سلسلة من تفاعلات الفسفرة التي تحفز امتصاص الجلوكوز وتخزينه؛ إذ تؤدي مقاومة الإنسولين إلى ضعف في هذه الإشارات الفسفورية، مما يرفع مستويات السكر في الدم. وكذلك في الأمراض العصبية التنكسية مثل الزهايمر وباركنسون، نجد أنماطاً غير طبيعية من الفسفرة في بروتينات عصبية محددة. في مرض الزهايمر، يتعرض بروتين تاو (Tau) لفسفرة مفرطة، مما يؤدي إلى تكوين التشابكات الليفية العصبية التي تميز المرض. هذا وقد أظهرت الأبحاث أن استهداف الكينازات المسؤولة عن فسفرة تاو قد يمثل إستراتيجية علاجية واعدة.
كيف يستخدم الباحثون معرفتهم بالفسفرة في تطوير العلاجات؟
أصبحت الفسفرة هدفاً رئيساً في تطوير الأدوية الحديثة. مع اكتشاف الدور المحوري للكينازات في الأمراض، استثمرت شركات الأدوية بكثافة في تصميم مثبطات انتقائية. هذه المثبطات تعمل بطرق مختلفة: بعضها يحجب موقع ارتباط ATP في الكينازة، مما يمنعها من الحصول على الفوسفات اللازم لنشاطها. بينما يستهدف البعض الآخر مواقع تنظيمية أخرى في الإنزيم؛ إذ تتميز مثبطات الكينازات الحديثة بانتقائية عالية، مما يقلل من الآثار الجانبية المرتبطة بتثبيط كينازات أخرى غير مستهدفة.
بالإضافة إلى ذلك، يستخدم الباحثون تقنيات حديثة لدراسة الفسفرة على نطاق واسع. تقنية قياس الطيف الكتلي (Mass Spectrometry) تسمح بتحديد آلاف مواقع الفسفرة في البروتينات المختلفة في وقت واحد، مما يرسم خريطة شاملة لحالة الفسفرة الخلوية. ومما يثير الإعجاب أن هذه الخرائط تكشف عن شبكات إشارات معقدة لم تكن معروفة سابقاً، وتفتح آفاقاً جديدة لفهم الأمراض وتطوير علاجات مستهدفة. انظر إلى كيف أن التقدم التقني يعزز فهمنا للعمليات الحيوية الأساسية ويترجم هذا الفهم إلى تطبيقات طبية ملموسة.
الخاتمة
تمثل الفسفرة حجر الزاوية في التنظيم الخلوي والاستجابة للبيئة المحيطة. من التحكم في إنتاج الطاقة إلى تنظيم الانقسام الخلوي والنمو، تتغلغل هذه العملية في كل جانب من جوانب الحياة الخلوية. لقد أوضحت الأبحاث المتراكمة على مدى عقود أن فهم آليات الفسفرة ليس مجرد تمرين أكاديمي، بل هو ضرورة لمواجهة التحديات الصحية الكبرى التي تواجه البشرية. إن استمرارية البحث في هذا المجال تعد بمزيد من الاكتشافات التي قد تغير وجه الطب الحديث، وبالتالي تحسن جودة حياة الملايين حول العالم.
فهل أنت مستعد للتعمق أكثر في عالم الكيمياء الحيوية واستكشاف الآليات الجزيئية الدقيقة التي تحكم الحياة؟
الأسئلة الشائعة
ما الفرق بين الفسفرة التأكسدية والفسفرة على مستوى الركيزة؟
الفسفرة التأكسدية تحدث في الميتوكوندريا وتعتمد على سلسلة نقل الإلكترونات لإنتاج تدرج بروتوني يشغل إنزيم ATP سينثاز، وهي المسؤولة عن إنتاج معظم جزيئات ATP في الخلية. بالمقابل، الفسفرة على مستوى الركيزة تحدث مباشرة في السيتوبلازم أثناء التحلل السكري ودورة كريبس، إذ يتم نقل مجموعة الفوسفات مباشرة من مركب فوسفاتي عالي الطاقة إلى ADP دون الحاجة لسلسلة نقل الإلكترونات.
كيف تؤثر الفسفرة على الشكل الفراغي للبروتينات؟
عند إضافة مجموعة الفوسفات إلى البروتين، تدخل شحنات سالبة متعددة إلى البنية الجزيئية؛ إذ تتنافر هذه الشحنات مع المناطق السالبة الأخرى في البروتين وتنجذب إلى المناطق الموجبة، مما يؤدي إلى إعادة ترتيب الروابط الداخلية وتغيير الشكل الفراغي ثلاثي الأبعاد. هذا التغيير الشكلي قد يفتح أو يغلق المواقع النشطة في الإنزيمات، أو يكشف عن مناطق ارتباط جديدة، وبالتالي يغير وظيفة البروتين بشكل جذري.
لماذا تستخدم الخلية ATP كمصدر لمجموعة الفوسفات؟
يُعَدُّ ATP الناقل المثالي لمجموعات الفوسفات لأنه يحتوي على روابط فوسفاتية عالية الطاقة؛ إذ يطلق تحلل هذه الروابط طاقة كافية لدفع تفاعل الفسفرة إلى الأمام رغم أنه تفاعل يتطلب طاقة. كما أن ATP متوفر بكثرة في الخلية ويمكن تجديده باستمرار من خلال عمليات التنفس الخلوي والتمثيل الضوئي. من ناحية أخرى، يسمح هذا النظام بربط تفاعلات الفسفرة بالحالة الطاقوية للخلية، مما يجعلها آلية تنظيمية تستجيب لمستويات الطاقة المتاحة.
ما دور الفوسفاتازات في موازنة عملية الفسفرة؟
تعمل الفوسفاتازات كمنظمات سلبية تزيل مجموعات الفوسفات من البروتينات المفسفرة، مما يعيد البروتينات إلى حالتها الأصلية غير النشطة أو النشطة حسب الحالة. هذا التوازن الديناميكي بين نشاط الكينازات والفوسفاتازات يسمح بتنظيم دقيق وسريع للعمليات الخلوية؛ إذ يمكن تشغيل الإشارات الخلوية وإيقافها بسرعة استجابة للظروف المتغيرة. وعليه فإن اختلال هذا التوازن، بفرط نشاط الكينازات أو نقص نشاط الفوسفاتازات، يرتبط بالعديد من الأمراض بما فيها السرطان.
هل يمكن أن تحدث الفسفرة على أحماض أمينية غير السيرين والثريونين والتيروزين؟
نعم، رغم أن معظم الفسفرة في الخلايا حقيقية النواة تستهدف السيرين والثريونين والتيروزين، إلا أن أحماضاً أمينية أخرى يمكن أن تُفسفر في ظروف معينة. الهستيدين والأسبارتات يخضعان للفسفرة بشكل شائع في البكتيريا كجزء من أنظمة الإشارات ثنائية المكونات؛ إذ تكون هذه الفسفرة أقل استقراراً كيميائياً من فسفرة السيرين والثريونين. بالإضافة إلى ذلك، اكتشفت الأبحاث الحديثة حالات نادرة لفسفرة الأرجينين والليسين في الخلايا البشرية، لكن أهميتها الوظيفية لا تزال قيد الدراسة.
كيف تساهم الفسفرة في نقل الإشارات الخلوية؟
تشكل الفسفرة العمود الفقري لمعظم مسارات نقل الإشارات الخلوية من خلال التتابع الكينازي، إذ تقوم كينازة واحدة بفسفرة وتنشيط كينازة أخرى في سلسلة متتالية. هذا النظام يوفر عدة مزايا: التضخيم (حيث تنشط كل كينازة عدة نسخ من الكينازة التالية)، والتكامل (حيث تتلاقى إشارات متعددة على كينازة واحدة)، والمرونة (حيث يمكن تعديل الإشارة في نقاط متعددة). وبالتالي تستطيع الخلية تحويل إشارة هرمونية ضعيفة على سطحها إلى استجابة قوية ومنسقة في النواة أو العضيات الأخرى.
ما العلاقة بين الفسفرة ومرض السرطان؟
ترتبط الطفرات في الجينات المشفرة للكينازات أو منظماتها بنسبة كبيرة من حالات السرطان. عندما تصبح كينازات معينة مثل التي تتحكم في النمو والانقسام نشطة بشكل دائم نتيجة طفرة، تفقد الخلية قدرتها على التحكم في التكاثر؛ إذ تستمر في الانقسام حتى في غياب إشارات النمو الطبيعية. من جهة ثانية، قد تحدث طفرات في الفوسفاتازات التي تعمل كمثبطات للأورام، مما يؤدي لفقدان الآليات الكابحة للنمو. لقد أدى فهم هذه الآليات إلى تطوير أدوية مثبطات الكينازات التي حققت نجاحات كبيرة في علاج بعض أنواع السرطان.
كيف تختلف الفسفرة في الخلايا النباتية عن الحيوانية؟
تشترك الخلايا النباتية والحيوانية في الآليات الأساسية للفسفرة، لكن النباتات تمتلك نوعاً فريداً يُسمى الفسفرة الضوئية يحدث في البلاستيدات الخضراء. في هذه العملية، تُستخدم الطاقة الضوئية لتوليد تدرج بروتوني يشغل ATP سينثاز لإنتاج ATP؛ إذ يشبه هذا النظام الفسفرة التأكسدية في الميتوكوندريا لكنه يعتمد على الضوء بدلاً من الأكسدة الكيميائية. وكذلك تحتوي النباتات على عائلات كينازات فريدة تستجيب للإشارات الخاصة بها مثل الضوء والجفاف والهرمونات النباتية.
ما تقنيات البحث المستخدمة لدراسة الفسفرة؟
يستخدم الباحثون مجموعة متنوعة من التقنيات المتطورة لدراسة الفسفرة. قياس الطيف الكتلي يُعَدُّ الأداة الذهبية لتحديد مواقع الفسفرة بدقة على نطاق واسع عبر آلاف البروتينات في وقت واحد. تقنيات الأجسام المضادة الخاصة بالفوسفو-بروتينات تسمح بالكشف عن فسفرة بروتينات محددة في عينات بيولوجية؛ إذ توفر معلومات عن توزيعها الخلوي وتغيراتها عبر الزمن. بالإضافة إلى ذلك، تُستخدم تقنيات علم البلورات بالأشعة السينية والرنين المغناطيسي النووي لفهم التأثيرات البنيوية للفسفرة على البروتينات.
كيف تؤثر الأدوية على عمليات الفسفرة؟
تستهدف العديد من الأدوية الحديثة عمليات الفسفرة بطرق مختلفة. مثبطات الكينازات تمثل فئة كبيرة من الأدوية المضادة للسرطان والالتهابات، وتعمل بحجب الموقع النشط للكينازة أو منع ارتباطها بـ ATP؛ إذ صُممت هذه المثبطات لتكون انتقائية للكينازات المعطلة في المرض مع الحفاظ على الكينازات الطبيعية. من ناحية أخرى، بعض الأدوية تستهدف البروتينات المنظمة للكينازات أو تعزز نشاط الفوسفاتازات. ومما يثير الاهتمام أن أكثر من 50 مثبط كينازة معتمد حالياً للاستخدام السريري، مع مئات أخرى قيد التطوير.