الروابط الأيونية: كيف تتشكل وما هي خصائصها؟
ما الذي يجعل الملح يذوب في الماء والمعادن موصلة للكهرباء؟
تمثل الروابط الكيميائية أساس فهمنا لتركيب المادة وسلوكها في الطبيعة، ومن بين هذه الروابط تبرز الروابط الأيونية كواحدة من أكثر القوى الكيميائية وضوحاً وتأثيراً في عالمنا اليومي. إن فهم طبيعة هذه الروابط يفتح أمامنا نافذة واسعة لإدراك العديد من الظواهر الطبيعية والتطبيقات العملية التي نتعامل معها يومياً.
المقدمة
لقد شغل العلماء منذ القرن التاسع عشر بفهم الآليات التي تجعل الذرات ترتبط ببعضها البعض لتشكيل مركبات مستقرة. فقد لاحظوا أن بعض المواد تظهر خصائص مميزة كالصلابة العالية ودرجات الانصهار المرتفعة والقدرة على التوصيل الكهربائي عند إذابتها أو صهرها؛ إذ كانت هذه الملاحظات بداية لفهم عميق لطبيعة الروابط الأيونية. بالإضافة إلى ذلك، ساهمت اكتشافات الفيزيائيين حول البنية الذرية في تقديم تفسير منطقي لكيفية نشوء هذه الروابط القوية التي تربط الأيونات الموجبة بالأيونات السالبة في شبكة بلورية محكمة.
كما أن دراسة الروابط الأيونية لا تقتصر على الجانب النظري فحسب، بل تمتد لتشمل تطبيقات عملية واسعة في الصناعة والطب والتكنولوجيا الحديثة. إن ملح الطعام الذي نستخدمه يومياً، والأسمدة الزراعية، والبطاريات، وحتى العظام في أجسامنا، جميعها تحتوي على مركبات ترتبط مكوناتها عبر هذا النوع من الترابط الكيميائي.
ما هي الروابط الأيونية؟
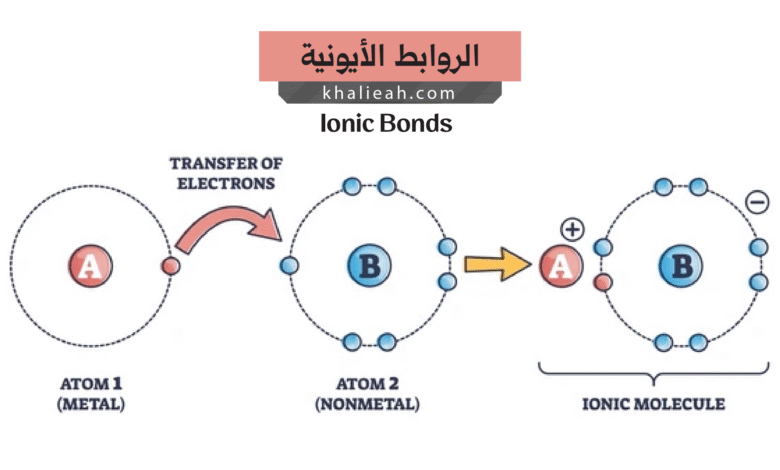
تُعَدُّ الروابط الأيونية نوعاً من الترابط الكيميائي ينشأ نتيجة التجاذب الكهروستاتيكي (Electrostatic Attraction) بين الأيونات ذات الشحنات المتعاكسة. فما هي الآلية التي تحكم هذا التجاذب؟ ببساطة، عندما تفقد ذرة ما إلكتروناً أو أكثر تصبح أيوناً موجباً يسمى الكاتيون (Cation)، بينما تصبح الذرة التي تكتسب إلكترونات أيوناً سالباً يعرف بالأنيون (Anion). وبالتالي، يحدث تجاذب قوي بين هذين النوعين من الأيونات بناءً على قانون كولوم (Coulomb’s Law)، الذي ينص على أن قوة التجاذب تتناسب طردياً مع حاصل ضرب الشحنتين وعكسياً مع مربع المسافة بينهما.
من ناحية أخرى، تختلف الروابط الأيونية عن أنواع الروابط الأخرى في كونها غير موجهة، أي أن قوة التجاذب تعمل في جميع الاتجاهات حول الأيون. إن هذه الخاصية تفسر لماذا تترتب الأيونات في أنماط هندسية منتظمة لتشكل ما نسميه الشبكة البلورية (Crystal Lattice)؛ إذ يحاول كل أيون أن يحيط نفسه بأكبر عدد ممكن من الأيونات ذات الشحنة المعاكسة لتحقيق أقصى استقرار ممكن. هذا الترتيب المنظم يمنح المركبات الأيونية بنية صلبة ومتماسكة في درجات الحرارة العادية.
كيف تتكون الروابط الأيونية؟
تتشكل الروابط الأيونية عادةً بين عنصرين يختلفان بشكل كبير في خاصية الكهروسالبية (Electronegativity)، وهي مقياس لقدرة الذرة على جذب الإلكترونات نحوها في الرابطة الكيميائية. فهل يا ترى جميع العناصر قادرة على تكوين روابط أيونية؟ الإجابة لا، فالروابط الأيونية تتشكل بشكل مثالي بين الفلزات (Metals) واللافلزات (Non-metals). لقد وُجد أن الفلزات الموجودة في المجموعات الأولى والثانية من الجدول الدوري، مثل الصوديوم والكالسيوم، تميل إلى فقدان إلكتروناتها بسهولة لتصبح كاتيونات موجبة.
على النقيض من ذلك، تميل اللافلزات، وخاصة تلك الموجودة في المجموعتين السادسة والسابعة مثل الأكسجين والكلور، إلى اكتساب الإلكترونات لتصبح أنيونات سالبة. إذاً كيف يحدث الانتقال الفعلي للإلكترونات؟ عندما يقترب ذرة صوديوم من ذرة كلور مثلاً، يتطلب الصوديوم طاقة أقل لفقدان إلكترونه الوحيد في المستوى الخارجي مقارنة بالطاقة المطلوبة لاكتساب سبعة إلكترونات لملء غلافه الخارجي؛ إذ يصبح أيون صوديوم موجب الشحنة (Na+). بالمقابل، يحتاج الكلور إلى إلكترون واحد فقط ليكمل غلافه الخارجي ويصبح مستقراً كأيون سالب (Cl-). وعليه فإن الإلكترون المفقود من الصوديوم ينتقل إلى الكلور، ومن ثم يحدث تجاذب كهروستاتيكي قوي بينهما مشكلاً كلوريد الصوديوم (NaCl)، المعروف لدينا بملح الطعام.
ما الفرق بين الروابط الأيونية والتساهمية؟
يكمن الفارق الأساسي بين الروابط الأيونية والروابط التساهمية (Covalent Bonds) في طريقة توزيع الإلكترونات بين الذرات المترابطة. ففي الروابط الأيونية، يحدث انتقال كامل للإلكترونات من ذرة إلى أخرى، مما ينتج عنه تكوين أيونات منفصلة ذات شحنات متعاكسة. بينما في الروابط التساهمية، تتشارك الذرات في الإلكترونات دون انتقالها بالكامل من ذرة لأخرى. إن هذا الاختلاف الجوهري يؤدي إلى خصائص فيزيائية وكيميائية مختلفة تماماً للمركبات الناتجة عن كل نوع من الترابط.
من جهة ثانية، نجد أن المركبات الأيونية تكون صلبة في درجة حرارة الغرفة ولها درجات انصهار وغليان مرتفعة جداً، وذلك بسبب القوى الكهروستاتيكية القوية التي تربط الأيونات في الشبكة البلورية. كما أن المركبات الأيونية توصل الكهرباء عندما تكون في الحالة المنصهرة أو المذابة في الماء، لأن الأيونات تصبح حرة الحركة. على النقيض من ذلك، المركبات التساهمية غالباً ما تكون غازية أو سائلة في درجة حرارة الغرفة، ولها درجات انصهار وغليان منخفضة نسبياً، ومعظمها لا يوصل الكهرباء حتى في حالة الذوبان.
ما هي الخصائص الفيزيائية للمركبات الأيونية؟
الخصائص البارزة
تتميز المركبات الأيونية بمجموعة من الخصائص الفيزيائية المميزة التي تنبع مباشرة من طبيعة الترابط الأيوني القوي. فقد أظهرت الدراسات المختبرية أن هذه المواد تمتلك صفات فريدة تجعلها مفيدة في تطبيقات متعددة. انظر إلى الملح الذي تضعه على طعامك، تلاحظ صلابته وبلوريته الواضحة؛ إذ تعكس هذه الخصائص البنية الداخلية المحكمة للشبكة الأيونية.
وكذلك تشمل الخصائص الفيزيائية للمركبات الأيونية ما يلي:
- صلابة عالية وهشاشة: تكون المركبات الأيونية صلبة جداً عند درجة حرارة الغرفة بسبب القوى الكهروستاتيكية القوية، لكنها في الوقت نفسه هشة وقابلة للكسر عند تعرضها لقوة ميكانيكية مفاجئة.
- درجات انصهار وغليان مرتفعة: يتطلب كسر الروابط الأيونية القوية كمية كبيرة من الطاقة الحرارية، مما يجعل هذه المركبات تنصهر وتغلي عند درجات حرارة عالية جداً.
- التوصيل الكهربائي: لا توصل المركبات الأيونية الكهرباء في حالتها الصلبة، لكنها تصبح موصلة ممتازة عندما تنصهر أو تذوب في الماء، لأن الأيونات تصبح حرة الحركة.
- القابلية للذوبان: معظم المركبات الأيونية قابلة للذوبان في المذيبات القطبية مثل الماء، بينما لا تذوب في المذيبات غير القطبية.
- الشفافية البلورية: كثير من المركبات الأيونية تكون شفافة أو شبه شفافة في حالتها البلورية النقية، مما يعكس الترتيب المنتظم للأيونات في الشبكة.
لماذا تذوب المركبات الأيونية في الماء؟
يُعَدُّ ذوبان المركبات الأيونية في الماء ظاهرة مثيرة للاهتمام تكشف الكثير عن طبيعة التفاعلات الجزيئية. إن جزيئات الماء تتمتع بخاصية القطبية (Polarity)، فهل سمعت بهذا المصطلح من قبل؟ يعني أن جزيء الماء يحتوي على طرف موجب جزئياً وطرف سالب جزئياً بسبب توزيع الإلكترونات غير المتساوي. هذا وقد تبين أن هذه القطبية هي المفتاح لفهم كيفية ذوبان الأملاح في الماء؛ إذ تنجذب الأطراف الموجبة من جزيئات الماء نحو الأيونات السالبة، بينما تنجذب الأطراف السالبة نحو الأيونات الموجبة.
بالإضافة إلى ذلك، تحدث عملية تسمى الإماهة (Hydration) أو الإذابة المائية، تحيط فيها جزيئات الماء بالأيونات الفردية وتعزلها عن بعضها البعض. ومما يزيد من فعالية هذه العملية أن الطاقة المنطلقة من تكوين روابط هيدروجينية بين الماء والأيونات تعوض جزئياً أو كلياً الطاقة المطلوبة لكسر الشبكة البلورية الأيونية. الجدير بالذكر أن درجة قابلية الذوبان تختلف من مركب أيوني لآخر اعتماداً على عدة عوامل، منها حجم الأيونات، وشحنتها، وطاقة الشبكة البلورية. فبعض المركبات مثل كلوريد الصوديوم تذوب بسهولة كبيرة، بينما مركبات أخرى مثل كبريتات الباريوم تكاد لا تذوب في الماء.
كيف تؤثر طاقة الشبكة البلورية على استقرار المركبات؟
تمثل طاقة الشبكة البلورية (Lattice Energy) مقياساً للقوة التي تربط الأيونات في البلورة الصلبة، وتُعرف بأنها الطاقة المنطلقة عندما تتجمع الأيونات الغازية المنفصلة لتشكيل مول واحد من المركب الأيوني الصلب. برأيكم ماذا يحدث عندما تكون هذه الطاقة كبيرة جداً؟ الإجابة هي أن المركب يصبح أكثر استقراراً وأصعب في الكسر أو الذوبان. لقد أثبتت القياسات التجريبية أن طاقة الشبكة البلورية تتأثر بعاملين رئيسيين: شحنة الأيونات وحجمها.
إذاً كيف يعمل هذان العاملان معاً؟ كلما زادت الشحنة على الأيونات، زادت قوة التجاذب الكهروستاتيكي بينها، وبالتالي زادت طاقة الشبكة البلورية. فمثلاً، أكسيد المغنيسيوم (MgO) الذي يحتوي على أيونات ثنائية الشحنة (Mg²⁺ و O²⁻) له طاقة شبكة بلورية أعلى بكثير من كلوريد الصوديوم (NaCl) الذي يحتوي على أيونات أحادية الشحنة (Na⁺ و Cl⁻). من جهة ثانية، كلما صغر حجم الأيونات، اقتربت من بعضها أكثر في الشبكة البلورية، مما يزيد من قوة التجاذب ويرفع طاقة الشبكة؛ إذ يفسر هذا لماذا فلوريد الليثيوم (LiF) له طاقة شبكة بلورية عالية جداً مقارنة بيوديد السيزيوم (CsI)، رغم أن كليهما مركب أيوني أحادي الشحنة.
ما أمثلة الروابط الأيونية في حياتنا اليومية؟
تطبيقات متنوعة
تحيط بنا المركبات الأيونية في كل مكان، وتلعب أدواراً مهمة في حياتنا اليومية دون أن ندرك ذلك في كثير من الأحيان. إن أبسط مثال هو الملح الذي نستخدمه في الطعام، لكن التطبيقات تتجاوز ذلك بكثير لتشمل الصناعة والطب والزراعة. فمن هو يا ترى المسؤول عن صلابة أسناننا وعظامنا؟ إنه فوسفات الكالسيوم، وهو مركب أيوني يشكل المكون الأساسي للبنية الصلبة في جسم الإنسان.
ومما يستحق الذكر أن الأمثلة على المركبات الأيونية في حياتنا تشمل:
- كلوريد الصوديوم (NaCl): ملح الطعام المستخدم في الأغذية والمحاليل الطبية.
- كربونات الكالسيوم (CaCO₃): موجود في الحجر الجيري والرخام ومضادات الحموضة.
- فلوريد الصوديوم (NaF): يُستخدم في معجون الأسنان لحماية المينا من التسوس.
- كلوريد البوتاسيوم (KCl): يدخل في تركيب الأسمدة الزراعية والمكملات الغذائية.
- كبريتات النحاس (CuSO₄): يُستخدم في الزراعة كمبيد فطري وفي الصناعات الكيميائية.
- هيدروكسيد الصوديوم (NaOH): قاعدة قوية تُستخدم في صناعة الصابون والمنظفات.
- نترات الفضة (AgNO₃): تطبيقات طبية في علاج الجروح والحروق.
هل جميع المركبات الأيونية متشابهة؟
رغم أن جميع المركبات الأيونية تشترك في الآلية الأساسية للترابط عبر التجاذب الكهروستاتيكي، إلا أنها تظهر تنوعاً كبيراً في خصائصها وسلوكها. إن هذا التنوع ينبع من اختلافات في حجم الأيونات المكونة لها، وشحنتها، وترتيبها في الشبكة البلورية. فقد تجد مركبات أيونية ملونة مثل كبريتات النحاس الأزرق، بينما تكون مركبات أخرى مثل كلوريد الصوديوم عديمة اللون. كما أن بعض المركبات تذوب بسهولة في الماء، بينما يصعب ذوبان أخرى بشكل ملحوظ.
وبالتالي، يمكن تصنيف المركبات الأيونية حسب عدة معايير، منها نسبة الشحنة إلى الحجم، والتركيب البلوري، والقطبية النسبية. إن بعض المركبات تحتوي على أيونات متعددة الذرات (Polyatomic Ions) مثل الكبريتات (SO₄²⁻) والنترات (NO₃⁻)، مما يمنحها خصائص إضافية ويزيد من تعقيد سلوكها الكيميائي. الجدير بالذكر أن دراسة هذه الاختلافات تساعد الكيميائيين على التنبؤ بخصائص المركبات وتصميم مواد جديدة بخصائص محددة للتطبيقات الصناعية والتكنولوجية المتقدمة.
الخاتمة
إن فهم الروابط الأيونية يشكل ركيزة أساسية في علم الكيمياء الحديثة، ويفتح الباب أمام تطبيقات لا حصر لها في مجالات الحياة المختلفة. لقد رأينا كيف أن هذا النوع من الترابط الكيميائي، القائم على الانتقال الكامل للإلكترونات والتجاذب الكهروستاتيكي، ينتج مركبات ذات خصائص فيزيائية وكيميائية مميزة. من الملح في طعامنا إلى المعادن في أجسامنا، من البطاريات التي تشغل أجهزتنا إلى الأسمدة التي تغذي محاصيلنا، تلعب المركبات الأيونية دوراً محورياً لا غنى عنه.
كما أن التطورات العلمية المستمرة في فهم طبيعة هذه الروابط تساهم في ابتكار مواد جديدة وتحسين التطبيقات الموجودة. إن دراسة طاقة الشبكة البلورية، وآليات الذوبان، والخصائص الفيزيائية للمركبات الأيونية تمثل مجالات بحثية نشطة تعد بتقدمات مهمة في المستقبل. وعليه فإن المعرفة العميقة بالروابط الأيونية ليست مجرد معلومة أكاديمية، بل هي أداة عملية تمكننا من فهم العالم من حولنا بشكل أفضل والتفاعل معه بطرق أكثر فعالية.
هل أنت مستعد الآن لاستكشاف المزيد من أنواع الروابط الكيميائية ومعرفة كيف تتكامل مع الروابط الأيونية لبناء عالمنا المادي؟