ثنائي إيثيل الإيثر: خصائصه التاريخية وتطبيقاته الصناعية والطبية
مقدمة في كيمياء وهُوية ثنائي إيثيل الإيثر
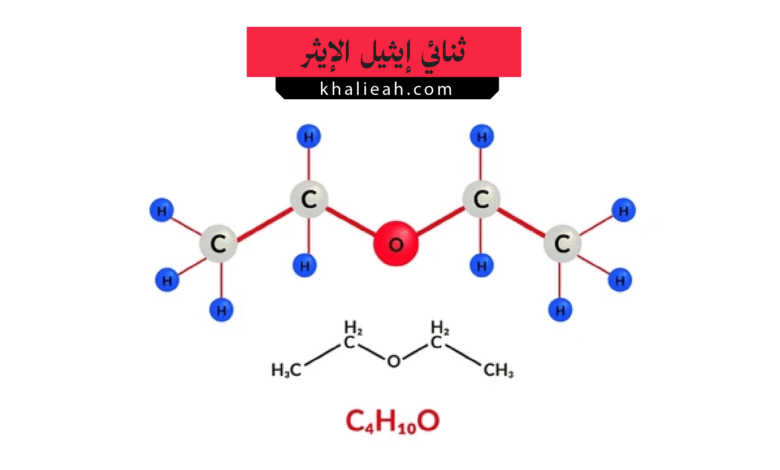
يُعد ثنائي إيثيل الإيثر (Diethyl Ether)، بتركيبته الكيميائية (C₂H₅)₂O، أحد أشهر المركبات العضوية في تاريخ الكيمياء والطب. ينتمي هذا المركب إلى فئة الإيthers، وهي مركبات تتميز بوجود ذرة أكسجين مرتبطة بمجموعتي ألكيل أو أريل. في حالة ثنائي إيثيل الإيثر، ترتبط ذرة الأكسجين بمجموعتي إيثيل (C₂H₅). يُعرف هذا المركب بأسماء أخرى مثل الإيثر الإيثيلي أو ببساطة “الإيثر”. وهو سائل عديم اللون، شديد التطاير (Volatility)، وله رائحة مميزة، حلوة ونفاذة، يمكن التعرف عليها بسهولة في المختبرات الكيميائية. إن الطبيعة المتطايرة لـ ثنائي إيثيل الإيثر تجعل أبخرته أثقل من الهواء، مما يعني أنها يمكن أن تتراكم في الأماكن المنخفضة وتشكل خطرًا كبيرًا للاشتعال.
تاريخيًا، كان اكتشاف ثنائي إيثيل الإيثر واستخدامه بمثابة نقطة تحول في الممارسة الطبية، خاصة في مجال الجراحة، حيث كان أول مخدر عام فعال ومستخدم على نطاق واسع. ومع ذلك، فإن تطبيقاته تتجاوز بكثير غرفة العمليات. ففي الكيمياء الصناعية والتحليلية، يلعب ثنائي إيثيل الإيثر دورًا حيويًا كمذيب غير قطبي (Aprotic Solvent) ممتاز، وكمادة بادئة في العديد من التفاعلات الكيميائية. على الرغم من تراجع استخدامه الطبي بسبب مخاطر السلامة وظهور بدائل أكثر أمانًا، يظل ثنائي إيثيل الإيثر مركبًا ذا أهمية مزدوجة: فهو أثر تاريخي يمثل فجر التخدير الحديث، وفي الوقت نفسه أداة لا غنى عنها في الكيمياء العضوية المعاصرة. تستعرض هذه المقالة بشكل أكاديمي ومباشر الجوانب المتعددة لهذا المركب، بدءًا من تاريخه المثير، مرورًا بخصائصه الكيميائية والفيزيائية الدقيقة، واستعراض تطبيقاته المتنوعة، وانتهاءً بتناول اعتبارات السلامة الحيوية المرتبطة بالتعامل معه.
الاكتشاف التاريخي والأهمية الطبية المبكرة
يمتد تاريخ ثنائي إيثيل الإيثر إلى قرون مضت، حيث كانت بداياته غامضة ومليئة بالتجارب الخيميائية. يُنسب التخليق الأول للمركب إلى الخيميائي الألماني فاليريوس كوردوس (Valerius Cordus) في عام 1540. قام كوردوس بتقطير خليط من الإيثانول وحمض الكبريتيك، وأطلق على المنتج اسم “الزاج الحلو” (oleum dulce vitrioli)، وهو ما نعرفه اليوم باسم ثنائي إيثيل الإيثر. لاحظ كوردوس خصائصه المسكنة، لكنه لم يدرك إمكاناته الكاملة كمخدر. وفي وقت لاحق، درس الخيميائي الشهير باراسيلسوس (Paracelsus) خصائص المركب على الدجاج ولاحظ تأثيره المنوم، لكن هذه الاكتشافات ظلت طي الكتمان لقرون.
لم تظهر الأهمية الحقيقية لمركب ثنائي إيثيل الإيثر إلا في القرن التاسع عشر. في أربعينيات هذا القرن، كانت الجراحة عملية مروعة ومؤلمة للغاية، وغالبًا ما كانت نسبة الوفيات مرتفعة بسبب الصدمة والألم. كان البحث عن عامل فعال لتخفيف الألم أثناء العمليات الجراحية أولوية قصوى. في 16 أكتوبر 1846، أجرى طبيب الأسنان الأمريكي ويليام تي. جي. مورتون (William T. G. Morton) أول عرض عام ناجح لاستخدام ثنائي إيثيل الإيثر كمخدر جراحي في مستشفى ماساتشوستس العام في بوسطن. قام مورتون بتخدير مريض يُدعى جيلبرت أبوت، مما سمح للجراح جون كولينز وارين (John Collins Warren) بإزالة ورم من عنق المريض دون أن يشعر الأخير بأي ألم. بعد انتهاء العملية، أعلن وارين جملته الشهيرة: “أيها السادة، هذه ليست خدعة”.
كان هذا الحدث بمثابة ثورة في عالم الطب. فتح استخدام ثنائي إيثيل الإيثر الباب أمام إجراء عمليات جراحية أكثر تعقيدًا وطولًا، والتي كانت مستحيلة في السابق. انتشر استخدام ثنائي إيثيل الإيثر بسرعة في جميع أنحاء العالم، وأصبح يُعرف ببساطة باسم “الإيثر”. على الرغم من آثاره الجانبية، مثل الغثيان والقيء بعد الجراحة، وقابليته الشديدة للاشتعال، فقد ظل المخدر المفضل لعقود طويلة. لقد أحدث ثنائي إيثيل الإيثر نقلة نوعية في الجراحة، محولاً إياها من تجربة وحشية إلى إجراء طبي يمكن التحكم فيه وإنقاذ الأرواح. هذا الدور الرائد يضمن لمركب ثنائي إيثيل الإيثر مكانة فريدة في تاريخ الطب.
الخصائص الكيميائية والفيزيائية
لفهم التطبيقات المتنوعة والمخاطر المرتبطة بـ ثنائي إيثيل الإيثر، من الضروري دراسة خصائصه الكيميائية والفيزيائية بالتفصيل. هذه الخصائص هي التي تحدد سلوكه كمذيب، وقابليته للاشتعال، وتفاعلاته الكيميائية.
التركيب الجزيئي وطرق التخليق
التركيب الجزيئي لـ ثنائي إيثيل الإيثر بسيط نسبيًا، حيث تتكون بنيته من ذرة أكسجين مركزية مرتبطة بمجموعتي إيثيل (CH₃CH₂-). الزاوية بين الرابطتين C-O-C تبلغ حوالي 112 درجة، والشكل الهندسي للجزيء منحنٍ، مشابه لجزيء الماء ولكن بزاوية أكبر بسبب التنافر الفراغي بين مجموعتي الإيثيل الضخمتين. هذه البنية تمنح الجزيء عزمًا ثنائي القطب (Dipole Moment) صغيرًا، مما يجعله مذيبًا قطبيًا ضعيفًا نسبيًا.
يمكن تحضير ثنائي إيثيل الإيثر صناعيًا بعدة طرق. الطريقة الأكثر شيوعًا تاريخيًا وصناعيًا هي نزع الماء من الإيثانول باستخدام حمض قوي كعامل مساعد، عادةً حمض الكبريتيك. يتم التفاعل على مرحلتين عند درجة حرارة تبلغ حوالي 140 درجة مئوية. في الخطوة الأولى، يتفاعل الإيثانول مع حمض الكبريتيك لتكوين كبريتات الإيثيل الهيدروجينية. في الخطوة الثانية، تتفاعل هذه المادة الوسيطة مع جزيء إيثانول آخر لإنتاج ثنائي إيثيل الإيثر وتجديد حمض الكبريتيك. من المهم التحكم في درجة الحرارة، فإذا ارتفعت فوق 170 درجة مئوية، فإن التفاعل السائد يصبح نزع الماء داخل الجزيء الواحد من الإيثانول لإنتاج الإيثيلين.
طريقة أخرى مهمة لتخليق ثنائي إيثيل الإيثر، خاصة في المختبر، هي تفاعل ويليامسون لتخليق الإيثر (Williamson Ether Synthesis). يتضمن هذا التفاعل معالجة هاليد الألكيل (مثل بروميد الإيثيل) مع ألكوكسيد الصوديوم (مثل إيثوكسيد الصوديوم). ينتج عن هذا التفاعل من نوع SN2 تكوين ثنائي إيثيل الإيثر وملح الصوديوم. تُعد هذه الطريقة متعددة الاستخدامات ويمكن تطبيقها لتخليق مجموعة واسعة من الإيثرات غير المتماثلة.
الخصائص الفيزيائية الرئيسية
يتميز ثنائي إيثيل الإيثر بخصائص فيزيائية فريدة تجعله مفيدًا وخطيرًا في آن واحد.
- التطاير ودرجة الغليان: لديه درجة غليان منخفضة جدًا تبلغ 34.6 درجة مئوية عند الضغط الجوي القياسي. هذا يعني أنه يتبخر بسرعة كبيرة في درجة حرارة الغرفة. ترجع هذه القابلية العالية للتطاير في ثنائي إيثيل الإيثر إلى ضعف قوى التجاذب بين جزيئاته (قوى فان دير فالس)، وعدم قدرته على تكوين روابط هيدروجينية بين جزيئاته، على عكس الكحولات المقابلة مثل الإيثانول (درجة غليانه 78 درجة مئوية).
- الكثافة: كثافة سائل ثنائي إيثيل الإيثر تبلغ حوالي 0.713 جم/سم³، مما يجعله أخف من الماء. عند خلطه بالماء، فإنه يشكل طبقة علوية منفصلة. أما كثافة بخاره فهي حوالي 2.56 مرة أكبر من كثافة الهواء، وهذا يعني أن الأبخرة ستستقر في المناطق المنخفضة، مما يزيد من خطر الحريق والانفجار.
- الذوبانية: يُظهر ثنائي إيثيل الإيثر قابلية ذوبان محدودة في الماء (حوالي 6.9 جم لكل 100 مل عند 20 درجة مئوية). في المقابل، يذوب الماء بكميات صغيرة في ثنائي إيثيل الإيثر (حوالي 1.5 جم لكل 100 مل). هذه الذوبانية المتبادلة المحدودة تجعله مذيب استخلاص ممتاز. وهو قابل للامتزاج تمامًا مع معظم المذيبات العضوية مثل الكحولات والكلوروفورم والبنزين.
التفاعلية الكيميائية وتكوين البيروكسيد
على الرغم من أن ثنائي إيثيل الإيثر يعتبر مستقرًا نسبيًا وغير تفاعلي في الظروف العادية، إلا أنه يخضع لبعض التفاعلات المهمة. كإيثر، يمكن أن يعمل كقاعدة لويس (Lewis Base) ضعيفة، حيث يمكن لزوج الإلكترونات غير الرابط على ذرة الأكسجين التبرع لتكوين معقدات مع أحماض لويس، مثل كواشف جرينيارد (Grignard reagents)، مما يساعد على استقرارها في المحلول.
الخطر الكيميائي الأبرز لـ ثنائي إيثيل الإيثر هو قدرته على تكوين بيروكسيدات متفجرة عند تعرضه للهواء والضوء لفترات طويلة. يتفاعل ثنائي إيثيل الإيثر ببطء مع الأكسجين الجوي من خلال آلية جذرية حرة لتكوين هيدروبيروكسيدات وبيروكسيدات عضوية. هذه المركبات غير متطايرة وتتركز في الوعاء مع تبخر ثنائي إيثيل الإيثر. البيروكسيدات حساسة للغاية للصدمات والحرارة، ويمكن أن تنفجر بعنف عند تسخينها أو تقطيرها حتى الجفاف. لهذا السبب، يجب تخزين ثنائي إيثيل الإيथर في عبوات محكمة الإغلاق، غير شفافة، وغالبًا ما تُضاف إليه مثبتات مثل هيدروكسي تولوين البوتيلي (BHT) لمنع عملية الأكسدة.
التطبيقات الصناعية والمختبرية الحديثة
على الرغم من أن شهرة ثنائي إيثيل الإيثر تأتي من تاريخه كمخدر، فإن استخدامه الرئيسي في العصر الحديث يتركز في المجال الصناعي والمختبري، حيث تُستغل خصائصه الفريدة كمذيب ومادة متفاعلة.
دوره كمذيب لا قطبي
الاستخدام الأبرز لـ ثنائي إيثيل الإيثر في الكيمياء العضوية هو كمذيب لا قطبي (Aprotic Solvent). طبيعته غير التفاعلية نسبيًا، ودرجة غليانه المنخفضة التي تسهل إزالته من خليط التفاعل بالتبخير، وقدرته على إذابة مجموعة واسعة من المركبات العضوية غير القطبية، تجعله خيارًا مثاليًا للعديد من التطبيقات.
أحد أهم هذه التطبيقات هو استخدامه في تفاعلات جرينيارد. كاشف جرينيارد (R-MgX) هو مركب عضوي فلزي شديد التفاعلية. يعمل ثنائي إيثيل الإيثر كمذيب مثالي لهذه التفاعلات لأنه لا يتفاعل مع الكاشف، والأهم من ذلك، أنه يعمل على استقرار كاشف جرينيارد من خلال التناسق (coordination) بين أزواج الإلكترونات الحرة على ذرة الأكسجين في الإيثر وذرة المغنيسيوم الحمضية في الكاشف. هذا التناسق يمنع الكاشف من التكتل ويحافظ على نشاطه.
كما يُستخدم ثنائي إيثيل الإيثر على نطاق واسع كمذيب للاستخلاص السائل-السائل (Liquid-Liquid Extraction). تُستخدم هذه التقنية لفصل المركبات بناءً على قابليتها للذوبان المختلفة في مذيبين غير قابلين للامتزاج (عادة الماء ومذيب عضوي). على سبيل المثال، يستخدم ثنائي إيثيل الإيثر لاستخلاص الكافيين من حبوب القهوة أو أوراق الشاي، واستخلاص المنتجات الطبيعية مثل القلويات والزيوت العطرية من المواد النباتية. قدرته على إذابة المركبات العضوية مع ذوبانه المحدود في الماء تجعله فعالاً للغاية في سحب المركب المطلوب من الطور المائي إلى الطور العضوي.
استخدامات أخرى في الصناعة والكيمياء
إلى جانب دوره كمذيب، يجد ثنائي إيثيل الإيثر تطبيقات أخرى في الصناعة.
- وقود التشغيل الأولي: تُستغل خاصية التطاير الشديد وانخفاض درجة حرارة الاشتعال الذاتي في ثنائي إيثيل الإيثر في تصنيع سوائل تشغيل المحركات (Starting Fluids). يتم رش هذه السوائل في مدخل الهواء للمحركات، خاصة محركات الديزل، في الطقس البارد. يشتعل بخار ثنائي إيثيل الإيثر بسهولة تحت ضغط منخفض، مما يساعد على بدء عملية الاحتراق وتشغيل المحرك عندما يكون الوقود التقليدي أقل تطايرًا.
- مادة متفاعلة: في بعض الحالات، يمكن استخدام ثنائي إيثيل الإيثر كمادة بادئة في التخليق الكيميائي، على الرغم من أن هذا أقل شيوعًا من استخدامه كمذيب. على سبيل المثال، يمكن أن يخضع لتفاعلات الانقسام بواسطة الأحماض القوية مثل حمض الهيدروبروميك لإنتاج بروميد الإيثيل.
- صناعة البلاستيك والمتفجرات: تاريخيًا، كان ثنائي إيثيل الإيثر مذيبًا مهمًا في إنتاج نترات السليلوز (النيتروسليلوز)، وهو مكون رئيسي في صناعة البلاستيك المبكر (مثل السليولويد) والبارود عديم الدخان.
إن تعدد استخدامات ثنائي إيثيل الإيثر في المختبر والصناعة يضمن استمرار أهميته كمركب كيميائي أساسي، حتى مع تضاؤل دوره في الطب. إن فهم خصائصه يسمح للكيميائيين والمهندسين بتسخير إمكاناته مع إدارة المخاطر المرتبطة به.
التخدير: الآلية، المزايا، والعيوب التاريخية
كان دور ثنائي إيثيل الإيثر كمخدر عام هو ما وضعه على الخريطة العالمية. لفهم تأثيره، من المهم تحليل آلية عمله، والمزايا التي قدمها في عصره، والعيوب التي أدت في النهاPEG إلى استبداله بمركبات أحدث.
آلية العمل كمخدر
الآلية الدقيقة التي يسبب بها ثنائي إيثيل الإيثر وغيره من المخدرات المستنشقة فقدان الوعي وتسكين الألم لا تزال موضوع بحث مكثف. النظرية الأكثر قبولًا حاليًا هي “نظرية الدهن” أو نظرية ماير-أوفيرتون (Meyer-Overton theory)، التي تقترح أن فاعلية المخدر ترتبط ارتباطًا مباشرًا بقابليته للذوبان في الدهون. يُعتقد أن جزيئات ثنائي إيثيل الإيثر تذوب في الأغشية الخلوية الدهنية للخلايا العصبية في الدماغ. هذا الذوبان يغير من سيولة وتركيب الغشاء، مما يؤثر على وظيفة البروتينات الحيوية المدمجة فيه، مثل قنوات الأيونات (ion channels) والمستقبلات.
على وجه الخصوص، يُعتقد أن ثنائي إيثيل الإيثر يعزز نشاط المستقبلات المثبطة مثل مستقبلات GABA-A (حمض غاما-أمينوبيوتيريك)، ويمنع نشاط المستقبلات المثيرة مثل مستقبلات NMDA (N-methyl-D-aspartate). التأثير الصافي هو تثبيط واسع النطاق لنشاط الخلايا العصبية في الجهاز العصبي المركزي، مما يؤدي إلى فقدان الوعي، وفقدان الذاكرة (amnesia)، وتسكين الألم (analgesia)، واسترخاء العضلات – وهي المكونات الأربعة الأساسية للتخدير العام.
المزايا التي جعلته رائدًا
عندما تم تقديمه، قدم ثنائي إيثيل الإيثر مزايا كبيرة مقارنة بالخيارات المتاحة آنذاك (مثل أكسيد النيتروز أو الكحول أو الأفيون).
- فاعلية عالية واسترخاء عضلي جيد: كان ثنائي إيثيل الإيثر قادرًا على إحداث تخدير عميق وموثوق به، مما سمح بإجراء عمليات جراحية طويلة ومعقدة. كما أنه يوفر استرخاءً ممتازًا للعضلات، وهو أمر حاسم لجراحة البطن والصدر.
- هامش أمان واسع نسبيًا: على الرغم من مخاطره، كان مؤشر أمان ثنائي إيثيل الإيثر (النسبة بين الجرعة السامة والجرعة الفعالة) واسعًا. هذا يعني أن هناك فرقًا كبيرًا بين الجرعة اللازمة للتخدير والجرعة التي تسبب تثبيطًا خطيرًا للتنفس أو القلب والأوعية الدموية. كان من الصعب نسبيًا إعطاء جرعة زائدة مميتة منه مقارنة بالكلوروفورم الذي ظهر بعده بفترة وجيزة.
- تأثير منبه على التنفس: على عكس العديد من المخدرات الأخرى التي تثبط التنفس، كان لـ ثنائي إيثيل الإيثر تأثير منبه طفيف على التنفس عند الجرعات التخديرية الأولية، مما اعتبر ميزة أمان إضافية.
العيوب التي أدت إلى تراجعه
على الرغم من نجاحه، كان لـ ثنائي إيثيل الإيثر عيوب كبيرة أدت في النهاية إلى البحث عن بدائل.
- القابلية الشديدة للاشتعال والانفجار: كان هذا هو الخطر الأكبر. أبخرة ثنائي إيثيل الإيثر يمكن أن تشتعل بسهولة بواسطة شرارة من المعدات الكهربائية أو الكهرباء الساكنة، مما أدى إلى حرائق وانفجارات مميتة في غرف العمليات.
- بطء بدء التأثير والتعافي: يستغرق ثنائي إيثيل الإيثر وقتًا طويلاً نسبيًا (10-15 دقيقة) لإحداث التخدير، وكان التعافي منه بطيئًا وغير سار.
- الآثار الجانبية المزعجة: كان المرضى يعانون بشكل شائع من الغثيان والقيء الشديدين بعد الجراحة، مما قد يؤدي إلى مضاعفات مثل الالتهاب الرئوي التنفسي (aspiration pneumonia). كما أنه يسبب تهيجًا في الجهاز التنفسي وزيادة في إفراز اللعاب والمخاط.
بحلول منتصف القرن العشرين، تم تطوير مخدرات مستنشقة مهلجنة أحدث وأكثر أمانًا، مثل الهالوثان (Halothane) والأيزوفلوران (Isoflurane)، والتي كانت غير قابلة للاشتعال، وأسرع في التأثير والتعافي، ولها آثار جانبية أقل. ونتيجة لذلك، تم استبدال ثنائي إيثيل الإيثر تدريجيًا في الممارسة الطبية في معظم أنحاء العالم، على الرغم من أنه لا يزال يستخدم في بعض المناطق الريفية أو التي تفتقر إلى الموارد بسبب تكلفته المنخفضة وسهولة استخدامه.
السلامة والتعامل والمخاطر الصحية
تتطلب معالجة ثنائي إيثيل الإيثر في أي سياق، سواء كان صناعيًا أو مختبريًا، فهمًا عميقًا لمخاطره واتباع بروتوكولات سلامة صارمة. المخاطر الرئيسية هي القابلية للاشتعال، وتكوين البيروكسيد، والآثار الصحية.
خطر الحريق والانفجار
الخطر الأكبر المرتبط بـ ثنائي إيثيل الإيثر هو قابليته الشديدة للاشتعال. لديه نقطة وميض (Flash Point) منخفضة للغاية تبلغ -45 درجة مئوية، مما يعني أنه يمكن أن يطلق أبخرة كافية لتكوين خليط قابل للاشتعال مع الهواء عند درجات حرارة منخفضة جدًا. كما أن له حدود انفجار واسعة (1.9% إلى 36% في الهواء)، مما يعني أن مجموعة واسعة من تراكيز البخار يمكن أن تشتعل. يجب تجنب جميع مصادر الاشتعال، بما في ذلك اللهب المكشوف، والأسطح الساخنة، والشرر الكهربائي، والكهرباء الساكنة، عند التعامل مع ثنائي إيثيل الإيثر. يجب أن يتم العمل به دائمًا في شفاط أبخرة (fume hood) جيد التهوية، ويجب تخزينه في حاويات مخصصة للسوائل القابلة للاشتعال بعيدًا عن الحرارة وأشعة الشمس المباشرة.
تكوين البيروكسيدات المتفجرة
كما ذكرنا سابقًا، تكوين البيروكسيدات المتفجرة هو خطر كامن آخر لـ ثنائي إيثيل الإيثر. يتشكل هذا الخطر عندما يتم تخزين الإيثر لفترة طويلة (أكثر من بضعة أشهر بعد الفتح) أو عندما يتم تخزينه بشكل غير صحيح. قبل استخدام أي حاوية قديمة من ثنائي إيثيل الإيثر، خاصة إذا كان سيتم تقطيرها، يجب اختبارها لوجود البيروكسيدات. يمكن إجراء اختبار بسيط عن طريق إضافة محلول يوديد البوتاسيوم (KI) المحمض؛ إذا تشكل لون أصفر أو بني (بسبب أكسدة اليوديد إلى اليود)، فهذا يشير إلى وجود بيروكسيدات. إذا تم الكشف عن بيروكسيدات، يجب معالجة الإيثر كيميائيًا لإزالتها قبل الاستخدام أو التخلص منها كنفايات خطرة. لا ينبغي أبدًا تقطير ثنائي إيثيل الإيثر حتى الجفاف، حيث تتركز البيروكسيدات غير المتطايرة في البقايا، مما يخلق خطر انفجار كبير.
الآثار الصحية والسمية
من الناحية الصحية، يُصنف ثنائي إيثيل الإيثر على أنه مهيج ومثبط للجهاز العصبي المركزي.
- الاستنشاق: استنشاق أبخرة ثنائي إيثيل الإيثر بتركيزات منخفضة يمكن أن يسبب تهيجًا في العينين والجهاز التنفسي، ودوخة، وصداعًا، وشعورًا بالنشوة مشابهًا للتسمم الكحولي. التركيزات الأعلى تؤدي إلى فقدان الوعي والتخدير. التعرض المفرط يمكن أن يسبب تثبيطًا تنفسيًا خطيرًا قد يؤدي إلى الوفاة.
- ملامسة الجلد والعين: يمكن أن يسبب ملامسة السائل للجلد تهيجًا وجفافًا بسبب إزالة الزيوت الطبيعية. ملامسة العين يمكن أن تسبب تهيجًا شديدًا.
- الابتلاع: ابتلاع ثنائي إيثيل الإيثر يمكن أن يسبب أعراضًا مشابهة للاستنشاق، بالإضافة إلى تهيج الجهاز الهضمي.
- التعرض المزمن: ارتبط التعرض المزمن لأبخرة ثنائي إيثيل الإيثر بمشاكل في الكلى والكبد، بالإضافة إلى الإدمان لدى بعض الأفراد الذين يسيئون استخدامه بسبب آثاره النفسية.
بسبب هذه المخاطر، يجب على العاملين الذين يتعاملون مع ثنائي إيثيل الإيثر استخدام معدات الوقاية الشخصية المناسبة، بما في ذلك القفازات المقاومة للمواد الكيميائية، والنظارات الواقية، والعمل في مناطق جيدة التهوية.
خاتمة: الإرث الدائم لمركب ثنائي القطبية
في الختام، يمثل ثنائي إيثيل الإيثر مركبًا كيميائيًا ذا تاريخ غني وإرث دائم. من أصوله في الخيمياء إلى دوره المحوري في ولادة التخدير الحديث، كان ثنائي إيثيل الإيثر في طليعة التقدم العلمي والطبي. لقد حرر المرضى من عذاب الجراحة وفتح آفاقًا جديدة للأطباء، مما ترك بصمة لا تُمحى على ممارسة الطب.
وفي العصر الحديث، على الرغم من أن دوره الطبي قد تضاءل، إلا أن أهمية ثنائي إيثيل الإيثر لم تتلاشَ. لقد انتقل ببساطة من غرفة العمليات إلى المختبر الصناعي والأكاديمي، حيث تظل خصائصه الفريدة كمذيب لا غنى عنها في التخليق العضوي والاستخلاص والعديد من العمليات الصناعية الأخرى. إن قصة ثنائي إيثيل الإيثر هي شهادة على الطبيعة المزدوجة للعديد من المركبات الكيميائية: فهي أدوات قوية يمكنها أن تجلب فوائد هائلة، ولكنها تتطلب أيضًا احترامًا عميقًا لمخاطرها الكامنة ومعالجة دقيقة. لا يزال ثنائي إيثيل الإيثر، برائحته المميزة وتاريخه الطويل، رمزًا للابتكار الكيميائي وأداة حيوية في ترسانة الكيميائيين في جميع أنحاء العالم.
الأسئلة الشائعة
1. لماذا اعتُبر استخدام ثنائي إيثيل الإيثر كمخدر ثورة في تاريخ الطب؟
اعتُبر تقديمه ثورة حقيقية لأنه حلّ المشكلة الأكثر إلحاحًا في الجراحة في منتصف القرن التاسع عشر: الألم الشديد والصدمة الجراحية. قبل عام 1846، كانت العمليات الجراحية تجارب وحشية وسريعة، حيث كان يتم تقييد المرضى، وكانت معدلات الوفيات مرتفعة للغاية بسبب الصدمة الفسيولوجية التي يسببها الألم الشديد. أتاح ثنائي إيثيل الإيثر لأول مرة إمكانية إدخال المريض في حالة من فقدان الوعي التام وتسكين الألم (التخدير العام)، مما سمح للجراحين بالعمل ببطء ودقة. هذا التحول لم يقلل من معاناة المرضى بشكل هائل فحسب، بل فتح الباب أمام إجراء عمليات جراحية أكثر تعقيدًا وتوغلاً في تجاويف الجسم (مثل البطن والصدر)، والتي كانت مستحيلة التنفيذ سابقًا. لقد حوّل الجراحة من عملية بتر سريعة إلى علم دقيق لإنقاذ الأرواح.
2. ما السبب الكيميائي وراء التطاير الشديد ودرجة الغليان المنخفضة لمركب ثنائي إيثيل الإيثر مقارنة بالإيثانول، رغم أن لهما وزنًا جزيئيًا متقاربًا؟
يكمن السبب الأساسي في نوع القوى البين-جزيئية (Intermolecular Forces) السائدة في كل مركب. يحتوي الإيثانول (C₂H₅OH) على مجموعة هيدروكسيل (-OH)، والتي تمكّن جزيئاته من تكوين روابط هيدروجينية قوية مع بعضها البعض. هذه الروابط تتطلب كمية كبيرة من الطاقة الحرارية لكسرها، مما يؤدي إلى درجة غليان مرتفعة نسبيًا (78 درجة مئوية). في المقابل، يفتقر ثنائي إيثيل الإيثر ((C₂H₅)₂O) إلى ذرة هيدروجين مرتبطة مباشرة بذرة الأكسجين، وبالتالي لا يستطيع تكوين روابط هيدروجينية بين جزيئاته. القوى الوحيدة التي تربط جزيئات الإيثر ببعضها هي قوى فان دير فالس الضعيفة والتفاعلات ثنائية القطب-ثنائية القطب. هذه القوى أضعف بكثير من الروابط الهيدروجينية، لذا يتطلب الأمر طاقة أقل بكثير لفصل الجزيئات وتحويلها إلى الحالة الغازية، مما ينتج عنه درجة غليان منخفضة جدًا (34.6 درجة مئوية) وتطاير شديد في درجة حرارة الغرفة.
3. اشرح الخطر الكبير لتكوين البيروكسيدات في ثنائي إيثيل الإيثر وكيف يمكن التعامل معه بأمان؟
يُعد تكوين البيروكسيدات المتفجرة أحد أخطر الخصائص الكيميائية لمركب ثنائي إيثيل الإيثر. عند تعرضه للأكسجين الجوي (الهواء) والضوء (خاصة الأشعة فوق البنفسجية)، يخضع الإيثر لعملية أكسدة ذاتية عبر آلية الجذور الحرة، مكونًا مركبات الهيدروبيروكسيد والبيروكسيدات العضوية. هذه البيروكسيدات غير متطايرة، لذا تتركز في الوعاء مع تبخر الإيثر. تكمن خطورتها في أنها حساسة للغاية للصدمات الميكانيكية، والاحتكاك، والحرارة. عند تسخينها، خاصة أثناء التقطير، يمكن أن تنفجر بعنف شديد.
لإدارة هذا الخطر:
- التخزين الصحيح: يجب تخزين ثنائي إيثيل الإيثر في عبوات معدنية أو زجاجية كهرمانية محكمة الإغلاق لمنع دخول الهواء والضوء.
- استخدام المثبتات: غالبًا ما يضاف إليه مثبتات كيميائية مثل هيدروكسي تولوين البوتيلي (BHT) لتعطيل تفاعل الجذور الحرة.
- تأريخ العبوات: يجب تدوين تاريخ فتح العبوة، ويُنصح بعدم استخدامها بعد 6-12 شهرًا من الفتح.
- الاختبار الدوري: قبل تقطير أي كمية من الإيثر، يجب اختبارها لوجود البيروكسيدات باستخدام شرائط اختبار أو محلول يوديد البوتاسيوم.
- عدم التقطير حتى الجفاف: من الأهمية بمكان عدم تقطير الإيثر حتى يجف تمامًا، لأن ذلك يركز البيروكسيدات في البقايا المتبقية.
4. لماذا يُعتبر ثنائي إيثيل الإيثر مذيبًا مثاليًا لتفاعلات جرينيارد (Grignard Reactions)؟
يُعتبر ثنائي إيثيل الإيثر المذيب الكلاسيكي والمثالي لتفاعلات جرينيارد لسببين كيميائيين رئيسيين:
- طبيعته غير المتفاعلة (Aprotic): لا يحتوي الإيثر على بروتونات حمضية (مثل تلك الموجودة في الكحول أو الماء)، والتي من شأنها أن تتفاعل مع كاشف جرينيارد شديد القاعدية وتدمره.
- قدرته على التذاوب والاستقرار: يعمل ثنائي إيثيل الإيثر كقاعدة لويس (Lewis Base) ضعيفة. تحتوي ذرة الأكسجين في الإيثر على زوجين من الإلكترونات غير الرابطة. تتناسق هذه الإلكترونات مع ذرة المغنيسيوم ذات النقص الإلكتروني في كاشف جرينيارد (R-Mg-X)، مكونة معقدًا مستقرًا. هذا التناسق (Solvation) يمنع كواشف جرينيارد من التجمع والتكتل، ويحافظ على قابليتها للذوبان ونشاطها التفاعلي في المحلول، مما يسهل تفاعلها مع الركيزة المطلوبة.
5. ما هي العيوب الأساسية التي أدت إلى تراجع استخدام ثنائي إيثيل الإيثر في التخدير السريري الحديث؟
على الرغم من دوره التاريخي، فإن ثنائي إيثيل الإيثر له عيوب كبيرة أدت إلى استبداله بمخدرات أحدث وأكثر أمانًا. العيوب الرئيسية هي:
- القابلية الشديدة للاشتعال والانفجار: كان هذا أكبر عائق، حيث يمكن لأبخرته أن تشتعل بسهولة من شرارة كهربائية من معدات المراقبة أو أدوات الجراحة الكهربائية، مما يشكل خطرًا مميتًا في غرفة العمليات.
- بطء بدء المفعول والتعافي: يستغرق التخدير وقتًا طويلاً نسبيًا (10-15 دقيقة) ليصبح فعالاً، كما أن فترة الإفاقة بطيئة وغير مريحة للمريض.
- الآثار الجانبية المرتفعة: يشتهر ثنائي إيثيل الإيثر بتسببه في الغثيان والقيء الشديدين بعد الجراحة، مما يزيد من خطر حدوث مضاعفات رئوية. كما أنه يسبب تهيجًا كبيرًا للمسالك الهوائية، مما يؤدي إلى زيادة إفراز اللعاب والمخاط.
- مرحلة الإثارة: أثناء بدء التخدير، يمر المرضى غالبًا بمرحلة من الهذيان والإثارة اللاإرادية، والتي قد تكون خطيرة.
6. كيف يتم تصنيع ثنائي إيثيل الإيثر على النطاق الصناعي والمختبري؟
توجد طريقتان رئيسيتان لتصنيع ثنائي إيثيل الإيثر:
- الطريقة الصناعية (نزع الماء من الإيثانول): هذه هي الطريقة الأكثر شيوعًا وفعالية من حيث التكلفة. يتم فيها تسخين الإيثانول مع عامل مساعد حمضي قوي، عادةً حمض الكبريتيك المركز، عند درجة حرارة يتم التحكم فيها بدقة عند حوالي 140 درجة مئوية. يتم التفاعل عبر تكوين مركب وسيط هو كبريتات الإيثيل الهيدروجينية، والذي يتفاعل بدوره مع جزيء إيثانول آخر لإنتاج ثنائي إيثيل الإيثر والماء، مع إعادة توليد الحمض.
- الطريقة المختبرية (تخليق ويليامسون للإيثر): تُستخدم هذه الطريقة على نطاق واسع في المختبرات لتخليق الإيثرات المتماثلة وغير المتماثلة. تتضمن هذه الطريقة تفاعل استبدال محب للنواة (SN2) بين أيون ألكوكسيد (مثل إيثوكسيد الصوديوم، C₂H₅ONa) وهاليد ألكيل أولي (مثل بروميد الإيثيل، C₂H₅Br) لإنتاج ثنائي إيثيل الإيثر وملح غير عضوي (بروميد الصوديوم).
7. ما هي الآلية البيوكيميائية المقترحة لعمل ثنائي إيثيل الإيثر كمخدر عام؟
الآلية الدقيقة لا تزال قيد البحث، ولكن النظرية الأكثر قبولاً هي أنه يعمل بشكل أساسي على مستوى المشابك العصبية (Synapses) في الجهاز العصبي المركزي. يُعتقد أن ثنائي إيثيل الإيثر، كونه مركبًا محبًا للدهون (Lipophilic)، يذوب في الأغشية الدهنية للخلايا العصبية. هذا التفاعل يغير من خصائص الغشاء ويؤثر على وظيفة البروتينات الحساسة المدمجة فيه، وخاصة قنوات الأيونات والمستقبلات العصبية. على وجه التحديد، يُظهر ثنائي إيثيل الإيثر تأثيرين رئيسيين:
- تعزيز التثبيط: يزيد من فعالية المستقبلات المثبطة، وأهمها مستقبلات GABA-A، مما يسمح بتدفق أيونات الكلوريد إلى داخل الخلية العصبية، وزيادة استقطابها، وجعلها أقل قابلية للاستثارة.
- تقليل الاستثارة: يثبط نشاط المستقبلات المثيرة، مثل مستقبلات NMDA و AMPA، مما يقلل من انتقال الإشارات العصبية المثيرة في الدماغ.
التأثير المشترك لهذين الإجراءين هو تثبيط شامل لنشاط الدماغ، مما يؤدي إلى فقدان الوعي والألم.
8. ما هو الدور الذي يلعبه ثنائي إيثيل الإيثر في عمليات الاستخلاص السائل-السائل (Liquid-Liquid Extraction)؟
يلعب ثنائي إيثيل الإيثر دورًا حيويًا كمذيب استخلاص ممتاز بسبب مجموعة من الخصائص المثالية:
- قابلية محدودة للامتزاج مع الماء: يشكل طبقة منفصلة عند خلطه مع الماء، وهو أمر ضروري لعملية الفصل.
- قدرة عالية على إذابة المركبات العضوية: يستطيع إذابة مجموعة واسعة من المركبات العضوية غير القطبية أو القطبية بشكل معتدل.
- كثافة منخفضة: كونه أخف من الماء، فإنه يشكل الطبقة العضوية العلوية، مما يسهل فصلها في قمع الفصل.
- تطاير عالي: درجة غليانه المنخفضة تجعل من السهل جدًا إزالته بالتبخير لاستعادة المركب المستخلص النقي.
في عملية الاستخلاص، يتم خلط محلول مائي يحتوي على المركب المطلوب مع ثنائي إيثيل الإيثر. ينتقل المركب العضوي بشكل تفضيلي من الطبقة المائية إلى طبقة الإيثر، وبعد فصل الطبقتين، يتم تبخير الإيثر للحصول على المنتج.
9. لماذا يستخدم ثنائي إيثيل الإيثر في سوائل بدء تشغيل المحركات، خاصة في الطقس البارد؟
يُستخدم ثنائي إيثيل الإيثر كمكون رئيسي في سوائل بدء تشغيل المحركات بسبب خاصيتين فيزيائيتين وكيميائيتين مهمتين:
- التطاير الشديد: حتى في درجات الحرارة شديدة البرودة، يتبخر ثنائي إيثيل الإيثر بسهولة لتكوين خليط قابل للاشتعال من البخار والهواء. هذا يتغلب على مشكلة صعوبة تبخر وقود الديزل أو البنزين في الطقس البارد.
- درجة حرارة اشتعال ذاتي منخفضة جدًا: تبلغ درجة حرارة الاشتعال الذاتي له حوالي 160 درجة مئوية فقط. هذا يعني أنه يشتعل بسهولة تحت الضغط الناتج عن شوط انضغاط المكبس، حتى بدون وجود شرارة قوية. هذا الاشتعال الأولي يوفر الحرارة اللازمة لإشعال الوقود الرئيسي (الديزل أو البنزين)، مما يسمح للمحرك بالبدء في العمل.
10. هل لـ “ثنائي إيثيل الإيثر” استخدامات أخرى غير كونه مذيبًا أو مخدرًا تاريخيًا؟
نعم، إلى جانب أدواره الرئيسية، كان لـ ثنائي إيثيل الإيثر استخدامات متخصصة أخرى. تاريخيًا، كان مذيبًا مهمًا في صناعة البلاستيك المبكر، وتحديدًا في إنتاج نترات السليلوز (النيتروسليلوز)، والتي كانت تستخدم في صناعة أفلام التصوير الفوتوغرافي، والبلاستيك مثل السليولويد، والبارود عديم الدخان. كما تم استخدامه كمادة تبريد في بعض الأنظمة المخبرية المبكرة بسبب تبخره السريع الذي يمتص كمية كبيرة من الحرارة (التبريد التبخيري). وفي بعض التطبيقات التحليلية، يستخدم كمذيب في تقنيات الفصل الكروماتوغرافي.