الذرة: بنيتها الداخلية، خصائصها التعريفية، وتفاعلاتها الكيميائية

مقدمة: تعريف الذرة وأهميتها الكونية
تُعَدُّ الذرة (Atom) الوحدة البنائية الأساسية التي تتكون منها جميع المواد في الكون، سواء كانت صلبة، أو سائلة، أو غازية، أو حتى في حالة البلازما. إنها أصغر جزء من العنصر الكيميائي يمكن أن يوجد مع الحفاظ على الخصائص الكيميائية لذلك العنصر. كل شيء نراه ونلمسه، من الهواء الذي نتنفسه إلى النجوم البعيدة في المجرات، يتكون في جوهره من تجمعات هائلة من هذه الوحدات الصغيرة. إن فهم طبيعة الذرة وبنيتها وسلوكها لم يكن مجرد إنجاز علمي، بل كان ثورة معرفية أعادت تشكيل نظرتنا للواقع المادي بأسره، وفتحت الأبواب أمام تقنيات غيرت وجه الحضارة الإنسانية.
على الرغم من صغر حجمها الذي لا يمكن تخيله، حيث يبلغ قطر الذرة حوالي 0.1 إلى 0.5 نانومتر (أي جزء من عشرة مليارات من المتر)، إلا أنها تمتلك بنية داخلية معقدة ومنظمة بدقة. تتألف كل الذرة من مكونين رئيسيين: نواة مركزية كثيفة للغاية، وسحابة من الإلكترونات تحيط بهذه النواة. تحتوي النواة على جسيمات موجبة الشحنة تسمى البروتونات وجسيمات متعادلة الشحنة تسمى النيوترونات، بينما تحمل الإلكترونات شحنة سالبة. إن التوازن الدقيق بين هذه الشحنات والتفاعلات بين هذه الجسيمات هو ما يمنح كل الذرة هويتها الفريدة ويحدد سلوكها الكيميائي. تستكشف هذه المقالة رحلة الفهم البشري للذرة، وتغوص في تفاصيل بنيتها الدقيقة، وتشرح كيف تحدد هذه البنية خصائصها وتفاعلاتها التي تشكل عالمنا.
رحلة استكشاف الذرة: من الفلسفة إلى الفيزياء الكمومية
لم تكن معرفتنا الحالية ببنية الذرة وليدة اللحظة، بل هي نتاج قرون من التفكير الفلسفي والتجريب العلمي الدقيق. بدأت الفكرة كبذرة في عقول فلاسفة الإغريق القدماء، وتحديدًا ديموقريطوس (Democritus) في القرن الخامس قبل الميلاد، الذي افترض أن المادة لا يمكن تقسيمها إلى ما لا نهاية، وأنه لا بد من وجود جسيمات أساسية غير قابلة للتجزئة أطلق عليها اسم “أتوموس” (Atomos)، والتي تعني “غير القابل للقطع”. كانت هذه مجرد فكرة فلسفية، لكنها وضعت حجر الأساس لمفهوم الذرة.
ظلت فكرة الذرة كامنة لآلاف السنين حتى مطلع القرن التاسع عشر، عندما أعاد العالم الإنجليزي جون دالتون (John Dalton) إحياءها ووضعها على أسس علمية من خلال نظريته الذرية. افترض دالتون أن كل عنصر كيميائي يتكون من نوع فريد من الذرات، وأن ذرات العنصر الواحد متطابقة في الكتلة والخصائص. كان نموذج دالتون يصور الذرة ككرة مصمتة صغيرة وغير قابلة للتجزئة، وهو نموذج بسيط لكنه نجح في تفسير قوانين الاتحاد الكيميائي في عصره.
جاءت القفزة التالية في فهم الذرة في عام 1897 على يد ج. ج. طومسون (J. J. Thomson)، الذي أدت تجاربه على أنابيب أشعة الكاثود إلى اكتشاف الإلكترون، وهو جسيم سالب الشحنة أصغر بكثير من الذرة نفسها. حطم هذا الاكتشاف فكرة أن الذرة غير قابلة للتجزئة. اقترح طومسون “نموذج فطيرة البرقوق” (Plum Pudding Model)، حيث تصور الذرة ككرة من الشحنة الموجبة تتوزع فيها الإلكترونات السالبة مثل الزبيب في الفطيرة، مما يجعل الذرة متعادلة كهربائيًا.
لكن هذا النموذج لم يصمد طويلاً. في عام 1909، أجرى إرنست رذرفورد (Ernest Rutherford) تجربته الشهيرة برقاقة الذهب، حيث قذف جسيمات ألفا الموجبة على شريحة رقيقة من الذهب. كانت النتائج مذهلة: معظم الجسيمات مرت مباشرة، لكن عددًا قليلاً جدًا ارتد بزوايا حادة. استنتج رذرفورد من ذلك أن معظم حجم الذرة فراغ، وأن شحنتها الموجبة وكتلتها تتركز في منطقة صغيرة وكثيفة جدًا في المركز أطلق عليها اسم “النواة” (Nucleus)، بينما تدور الإلكترونات حولها مثل الكواكب حول الشمس. لقد غير نموذج رذرفورد النووي فهمنا لشكل الذرة بشكل جذري.
واجه نموذج رذرفورد مشكلة كلاسيكية: لماذا لا تفقد الإلكترونات الدائرة طاقتها وتسقط في النواة؟ جاء الحل من نيلز بور (Niels Bohr) في عام 1913، الذي طبق مفاهيم الكم الناشئة على بنية الذرة. اقترح بور أن الإلكترونات لا يمكنها أن تدور إلا في مدارات ذات مستويات طاقة محددة ومكمّاة (Quantized). يمكن للإلكترون أن يقفز بين هذه المدارات عن طريق امتصاص أو إطلاق كمية محددة من الطاقة (فوتون)، لكنه لا يستطيع التواجد بينها. نجح نموذج بور في تفسير أطياف الانبعاث لذرة الهيدروجين، وقدم صورة أكثر استقرارًا للذرة.
أخيرًا، أدى تطور ميكانيكا الكم في عشرينيات القرن الماضي على أيدي علماء مثل إرفين شرودنغر (Erwin Schrödinger) وفيرنر هايزنبرغ (Werner Heisenberg) إلى النموذج الحديث للذرة، وهو النموذج الميكانيكي الكمومي. في هذا النموذج، لم تعد الإلكترونات توصف كجسيمات تدور في مسارات محددة، بل كموجات احتمالية. يصف هذا النموذج مناطق حول النواة تسمى “المدارات” (Orbitals)، وهي تمثل المناطق التي يرتفع فيها احتمال العثور على الإلكترون. مبدأ عدم اليقين لهايزنبرغ ينص على أنه من المستحيل تحديد موقع الإلكترون وزخمه بدقة في نفس الوقت. هذا النموذج الاحتمالي هو أدق وصف نمتلكه اليوم لسلوك الإلكترون داخل الذرة، وهو يمثل الذروة الحالية في رحلة فهمنا لهذه الوحدة البنائية الأساسية. إن تطور مفهوم الذرة يعكس قصة تطور العلم نفسه.
البنية الداخلية للذرة: النواة وسحابة الإلكترونات
تتسم البنية الداخلية للذرة بتنظيم مدهش على الرغم من حجمها المتناهي في الصغر. يمكن تقسيم الذرة بشكل أساسي إلى جزأين متميزين: النواة الذرية في المركز، والسحابة الإلكترونية التي تحيط بها.
1. النواة الذرية (Atomic Nucleus):
تقع النواة في مركز الذرة، وعلى الرغم من أنها تشغل جزءًا ضئيلاً جدًا من حجم الذرة (حوالي 1/100,000 من قطر الذرة)، إلا أنها تحتوي على أكثر من 99.9% من كتلتها الكلية. هذا يجعل النواة منطقة ذات كثافة هائلة بشكل لا يصدق. تتكون النواة من نوعين من الجسيمات، يشار إليهما مجتمعين باسم النيوكليونات (Nucleons):
- البروتونات (Protons): هي جسيمات تحمل شحنة كهربائية موجبة (+1). عدد البروتونات في نواة الذرة هو السمة المميزة التي تحدد هوية العنصر الكيميائي. على سبيل المثال، أي الذرة تحتوي على 6 بروتونات هي ذرة كربون، وأي الذرة تحتوي على 92 بروتونًا هي ذرة يورانيوم. يُطلق على عدد البروتونات اسم “العدد الذري” (Atomic Number).
- النيوترونات (Neutrons): هي جسيمات متعادلة كهربائيًا (لا تحمل شحنة) وكتلتها مساوية تقريبًا لكتلة البروتون. تتمثل الوظيفة الرئيسية للنيوترونات في تثبيت النواة. تعمل النيوترونات كـ “غراء” نووي يساعد على التغلب على قوة التنافر الكهربائي الهائلة بين البروتونات الموجبة، مما يمنع النواة من التفكك، خاصة في العناصر الثقيلة التي تحتوي على العديد من البروتونات.
تُمسك النيوكليونات معًا بواسطة القوة النووية الشديدة (Strong Nuclear Force)، وهي أقوى القوى الأساسية الأربع في الطبيعة، ولكنها تعمل على مسافات قصيرة جدًا داخل النواة فقط.
2. السحابة الإلكترونية (Electron Cloud):
تحيط بالنواة منطقة واسعة وفارغة في الغالب تُعرف بالسحابة الإلكترونية، وهي المنطقة التي تشغلها الإلكترونات.
- الإلكترونات (Electrons): هي جسيمات صغيرة جدًا وخفيفة الوزن تحمل شحنة كهربائية سالبة (-1)، تعادل في مقدارها شحنة البروتون الموجبة. كتلة الإلكترون ضئيلة جدًا مقارنة بكتلة البروتون أو النيوترون (حوالي 1/1836). في الذرة المتعادلة كهربائيًا، يكون عدد الإلكترونات التي تدور حول النواة مساويًا تمامًا لعدد البروتونات الموجودة داخلها، مما يجعل الشحنة الكلية للذرة صفرًا.
وفقًا للنموذج الميكانيكي الكمومي، لا تدور الإلكترونات حول النواة في مسارات دائرية محددة كما في نموذج بور. بدلاً من ذلك، توجد في “مدارات” (Orbitals)، وهي مناطق ثلاثية الأبعاد تمثل التوزيع الاحتمالي لوجود الإلكترون. هذه المدارات لها أشكال ومستويات طاقة مختلفة. يتم تنظيم الإلكترونات في “أغلفة طاقة” (Energy Shells) رئيسية، وكل غلاف يحتوي على أغلفة فرعية ومدارات محددة. إن توزيع الإلكترونات في هذه المدارات، وخاصة الإلكترونات الموجودة في الغلاف الخارجي، هو الذي يحدد الخصائص الكيميائية للذرة وقدرتها على تكوين روابط مع ذرات أخرى. وبالتالي، فإن فهم سلوك الإلكترون داخل الذرة هو مفتاح فهم علم الكيمياء بأكمله. إن كل الذرة في الكون تتبع هذا التركيب الأساسي.
الخصائص التعريفية للذرة: العدد الذري، العدد الكتلي، والنظائر
لكي نميز بين أنواع الذرات المختلفة ونفهم سلوكها، يستخدم العلماء مجموعة من الخصائص التعريفية التي تعتمد بشكل مباشر على مكونات الذرة الداخلية. هذه الخصائص لا تحدد هوية الذرة فحسب، بل توفر أيضًا نظرة ثاقبة حول استقرارها وكتلتها.
العدد الذري (Atomic Number – Z):
العدد الذري هو أهم خاصية تعريفية للذرة. إنه ببساطة عدد البروتونات الموجودة في نواة الذرة. كما ذكرنا سابقًا، هذا الرقم هو الذي يحدد هوية العنصر الكيميائي بشكل فريد. على سبيل المثال، كل ذرة في الكون تحتوي على بروتون واحد فقط هي ذرة هيدروجين (Z=1). وكل الذرة التي تحتوي على 8 بروتونات هي ذرة أكسجين (Z=8). لا يمكن أن توجد ذرتان من عنصرين مختلفين لهما نفس العدد الذري. في الذرة المتعادلة، يكون العدد الذري أيضًا مساويًا لعدد الإلكترونات. يتم ترتيب العناصر في الجدول الدوري تصاعديًا وفقًا لأعدادها الذرية.
العدد الكتلي (Mass Number – A):
العدد الكتلي هو إجمالي عدد البروتونات والنيوترونات (النيوكليونات) في نواة الذرة. يُكتب عادةً كرمز مرتفع على يسار رمز العنصر (على سبيل المثال، ¹²C). بما أن كتلة كل من البروتون والنيوترون تساوي تقريبًا وحدة كتلة ذرية واحدة (amu)، فإن العدد الكتلي يعطي تقديرًا جيدًا للكتلة الذرية الإجمالية للذرة. لحساب عدد النيوترونات في الذرة، نطرح ببساطة العدد الذري (Z) من العدد الكتلي (A):
عدد النيوترونات = A – Z.
على سبيل المثال، تحتوي ذرة الكربون-12 (¹²C) على عدد ذري 6 وعدد كتلي 12، مما يعني أنها تحتوي على 6 بروتونات و (12 – 6) = 6 نيوترونات.
النظائر (Isotopes):
بينما يظل عدد البروتونات ثابتًا لجميع ذرات عنصر معين، يمكن أن يختلف عدد النيوترونات. تُعرف الذرات التي تنتمي لنفس العنصر (لها نفس العدد الذري Z) ولكنها تحتوي على أعداد مختلفة من النيوترونات (وبالتالي أعداد كتلية A مختلفة) باسم النظائر.
على سبيل المثال، يوجد الكربون في الطبيعة بشكل أساسي في ثلاثة نظائر:
- الكربون-12 (¹²C): 6 بروتونات، 6 نيوترونات (الأكثر شيوعًا، حوالي 99%).
- الكربون-13 (¹³C): 6 بروتونات، 7 نيوترونات (مستقر، حوالي 1%).
- الكربون-14 (¹⁴C): 6 بروتونات، 8 نيوترونات (نادر وغير مستقر، أو مشع).
نظرًا لأن النظائر المختلفة لنفس العنصر لها نفس عدد البروتونات، فإنها تمتلك أيضًا نفس عدد الإلكترونات في حالتها المتعادلة. وبما أن التفاعلات الكيميائية تعتمد بشكل أساسي على سلوك الإلكترونات، فإن النظائر المختلفة لنفس العنصر لها خصائص كيميائية متطابقة تقريبًا. الفرق الرئيسي بينها يكمن في كتلتها واستقرارها النووي. بعض النظائر غير مستقرة وتخضع للاضمحلال الإشعاعي، مما يجعلها مفيدة في تطبيقات مثل التأريخ بالكربون المشع والطب النووي. إن مفهوم النظائر يوضح أن ليست كل ذرات العنصر الواحد متطابقة تمامًا، مما يشكل تعديلاً هامًا على نظرية دالتون الأصلية. إن كل الذرة يمكن تصنيفها بناء على هذه الخصائص.
الأيونات (Ions):
في حين أن الذرة تكون متعادلة كهربائيًا بشكل طبيعي، إلا أنها يمكن أن تكتسب أو تفقد إلكترونًا أو أكثر أثناء التفاعلات الكيميائية. عندما يحدث هذا، تصبح الذرة مشحونة كهربائيًا وتُعرف باسم “الأيون”.
- الكاتيون (Cation): أيون موجب الشحنة يتكون عندما تفقد الذرة إلكترونًا واحدًا أو أكثر. يصبح عدد البروتونات أكبر من عدد الإلكترونات. (مثال: Na⁺).
- الأنيون (Anion): أيون سالب الشحنة يتكون عندما تكتسب الذرة إلكترونًا واحدًا أو أكثر. يصبح عدد الإلكترونات أكبر من عدد البروتونات. (مثال: Cl⁻).
إن قدرة الذرة على تكوين الأيونات هي أساس تكوين الروابط الأيونية والمركبات الكيميائية.
الذرة والتفاعلات الكيميائية: دور إلكترونات التكافؤ
إن عالم الكيمياء برمته، من أبسط التفاعلات في المختبر إلى العمليات البيوكيميائية المعقدة في أجسامنا، هو في جوهره قصة تفاعل الذرات مع بعضها البعض. ما يحكم هذه التفاعلات ليس نواة الذرة، التي تظل سليمة في التفاعلات الكيميائية، بل إلكتروناتها، وتحديدًا تلك الموجودة في أبعد مدار عن النواة.
إلكترونات التكافؤ (Valence Electrons):
تُعرف الإلكترونات الموجودة في الغلاف الطاقي الخارجي للذرة باسم “إلكترونات التكافؤ”. هذه الإلكترونات هي الأقل ارتباطًا بالنواة والأكثر عرضة للتفاعل مع الذرات المجاورة. عدد إلكترونات التكافؤ وسلوكها هو العامل الحاسم الذي يحدد الخصائص الكيميائية للعنصر وقدرته على تكوين روابط. تميل الذرات إلى التفاعل بطريقة تجعلها تصل إلى حالة أكثر استقرارًا، والتي غالبًا ما تتمثل في الحصول على غلاف تكافؤ ممتلئ، عادةً بثمانية إلكترونات، وهي حالة تُعرف بـ “قاعدة الثمانيات” (Octet Rule).
لتحقيق هذا الاستقرار، يمكن للذرة أن تتبع إحدى الطرق الثلاث الرئيسية:
- فقدان الإلكترونات: تميل الذرات التي لديها عدد قليل من إلكترونات التكافؤ (مثل الفلزات القلوية كالصوديوم) إلى فقدان هذه الإلكترونات بسهولة لتكشف عن غلاف داخلي ممتلئ ومستقر. عند فقدانها للإلكترونات، تتحول الذرة إلى أيون موجب (كاتيون).
- اكتساب الإلكترونات: تميل الذرات التي لديها غلاف تكافؤ شبه ممتلئ (مثل الهالوجينات كالكلور) إلى اكتساب إلكترونات لملء غلافها وتحقيق الاستقرار. عند اكتسابها للإلكترونات، تتحول الذرة إلى أيون سالب (أنيون).
- مشاركة الإلكترونات: يمكن للذرات، خاصة اللافلزات، أن تشارك إلكترونات التكافؤ مع ذرات أخرى بحيث تشعر كل الذرة بأن غلافها الخارجي ممتلئ.
الروابط الكيميائية (Chemical Bonds):
إن سعي الذرة نحو الاستقرار يؤدي إلى تكوين روابط كيميائية، وهي القوى التي تربط الذرات معًا لتكوين الجزيئات والمركبات. هناك نوعان رئيسيان من الروابط القوية:
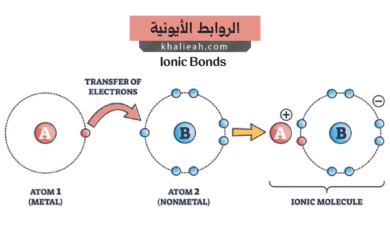
- الرابطة الأيونية (Ionic Bond): تتشكل هذه الرابطة عندما تنتقل إلكترونات التكافؤ بشكل كامل من الذرة (عادة فلز) إلى الذرة أخرى (عادة لافلز). ينتج عن هذا الانتقال تكوين أيونات موجبة وسالبة تتجاذب بقوة مع بعضها البعض بسبب القوى الكهروستاتيكية، مكونة مركبًا أيونيًا مثل ملح الطعام (كلوريد الصوديوم، NaCl).
- الرابطة التساهمية (Covalent Bond): تتشكل هذه الرابطة عندما تتشارك ذرتان أو أكثر في أزواج من إلكترونات التكافؤ. كل الذرة في الرابطة تساهم بإلكترون واحد (أو أكثر) في الزوج المشترك، وهذا الزوج المشترك يدور حول نواتي الذرتين، مما يربطهما معًا. هذه هي الطريقة التي تتشكل بها الجزيئات مثل الماء (H₂O) والميثان (CH₄).
في جوهر الأمر، كل تفاعل كيميائي هو عملية إعادة ترتيب للذرات عن طريق كسر روابط كيميائية قائمة وتكوين روابط جديدة. إن طبيعة الذرة المكونة للمادة هي ما يحدد نوع الروابط التي ستشكلها، وبالتالي خصائص المادة الناتجة. فذرة الكربون، بقدرتها على تكوين أربع روابط تساهمية قوية، تشكل العمود الفقري لجميع الجزيئات العضوية المعقدة التي تقوم عليها الحياة. إن فهم سلوك الذرة هو ما يسمح للكيميائيين بتصميم وتصنيع مواد جديدة، من الأدوية إلى البوليمرات المتقدمة.
تطبيقات الذرة في العصر الحديث: من الطاقة إلى الطب
إن فهمنا العميق لبنية الذرة وخصائصها لم يظل حبيس المختبرات والنظريات، بل أدى إلى تطوير تقنيات ثورية أثرت على كل جانب من جوانب حياتنا الحديثة. من خلال التلاعب بالذرة نفسها، تمكنا من تسخير قوى هائلة وتطوير أدوات تشخيصية وعلاجية غير مسبوقة.
الطاقة النووية (Nuclear Energy):
ربما يكون التطبيق الأكثر شهرة وقوة هو استغلال الطاقة الكامنة في نواة الذرة. على عكس التفاعلات الكيميائية التي تنطوي على إعادة ترتيب الإلكترونات، تتضمن التفاعلات النووية تغييرات في نواة الذرة نفسها، مما يطلق كميات هائلة من الطاقة. في محطات الطاقة النووية، تُستخدم عملية الانشطار النووي (Nuclear Fission)، حيث يتم قصف نواة الذرة ثقيلة وغير مستقرة، مثل اليورانيوم-235، بنيوترون. يؤدي هذا إلى انقسام النواة إلى نواتين أصغر، مع إطلاق عدد إضافي من النيوترونات وكمية هائلة من الطاقة على شكل حرارة. هذه الحرارة تستخدم لتسخين الماء وتوليد البخار الذي يدير التوربينات لإنتاج الكهرباء. إن الطاقة المنبعثة من انشطار الذرة الواحدة أكبر بملايين المرات من الطاقة المنبعثة من تفاعل كيميائي لذرة واحدة.
الطب النووي (Nuclear Medicine):
لقد أحدثت النظائر المشعة (Radioisotopes)، وهي نظائر غير مستقرة لذرات معينة، ثورة في مجال التشخيص والعلاج الطبي.
- التصوير الطبي: تُستخدم النظائر المشعة كـ “متتبعات” (Tracers) في تقنيات التصوير مثل التصوير المقطعي بالإصدار البوزيتروني (PET Scan). يتم حقن المريض بكمية ضئيلة من مادة تحتوي على الذرة مشعة، والتي تتراكم في أنسجة معينة أو أعضاء. يكشف الجهاز عن الإشعاع الصادر من هذه الذرات، مما يسمح للأطباء برؤية وظائف الأعضاء واكتشاف الأمراض مثل السرطان على المستوى الأيضي، وهو ما لا تستطيع تقنيات التصوير الأخرى فعله.
- العلاج الإشعاعي (Radiotherapy): تُستخدم الإشعاعات عالية الطاقة الصادرة عن اضمحلال الذرة المشعة لتدمير الخلايا السرطانية. يمكن توجيه الإشعاع بدقة إلى الورم لتقليل الضرر الذي يلحق بالأنسجة السليمة المحيطة.
علم المواد وتكنولوجيا النانو (Materials Science and Nanotechnology):
إن القدرة على فهم وترتيب الذرات الفردية قد فتحت حقلاً جديدًا بالكامل وهو تكنولوجيا النانو. في هذا المجال، يقوم العلماء والمهندسون ببناء هياكل ومواد وأجهزة عن طريق التحكم في المادة على مستوى الذرة والجزيء. لقد أدى هذا إلى تطوير مواد جديدة ذات خصائص فريدة، مثل أنابيب الكربون النانوية فائقة القوة وخفيفة الوزن، والجرافين، وهو طبقة من ذرات الكربون بسماكة الذرة واحدة فقط وله موصلية كهربائية وحرارية استثنائية. إن التحكم في الذرة بهذا المستوى يعد بمستقبل من الحوسبة الأسرع، والمواد الأكثر كفاءة، والتقنيات الطبية المتقدمة.
الخاتمة: الذرة، مفتاح فهم المادة
من مجرد فكرة فلسفية عن جسيم غير قابل للانقسام، إلى نموذج كمومي معقد يصف عالمًا من الاحتمالات، كانت رحلة فهم الذرة انعكاسًا للسعي البشري الدؤوب للمعرفة. لقد تعلمنا أن الذرة، على الرغم من بساطتها الظاهرية، هي عالم مصغر من التعقيد والقوة، تحكمه قوانين فيزيائية دقيقة. إنها الوحدة التي ينبثق منها كل التنوع الكيميائي في الكون، من أبسط جزيء هيدروجين إلى أعقد جزيء DNA.
إن البنية الداخلية للذرة، المكونة من نواة مركزية وسحابة إلكترونية، هي التي تحدد هوية كل عنصر، وكتلته، واستقراره، وسلوكه الكيميائي. إن التفاعلات بين إلكترونات التكافؤ هي التي تشكل الروابط التي تجمع المادة معًا، وهي أساس علم الكيمياء بأكمله. علاوة على ذلك، فإن تسخير القوة الهائلة الكامنة في نواة الذرة قد منحنا مصادر طاقة جديدة وأدوات طبية متطورة، مما يدل على أن فهم أعمق الأسرار في أصغر المقاييس يمكن أن يكون له أكبر الأثر على حضارتنا. إن قصة الذرة لم تنتهِ بعد؛ فمع كل اكتشاف جديد، نفتح فصلاً جديدًا في كتاب الكون، ونقترب أكثر من فهم جوهر وجودنا المادي. تظل الذرة الحجر الأساسي لكل العلوم الطبيعية، والرمز النهائي لكيفية بناء التعقيد الهائل من البساطة الأساسية.
الأسئلة الشائعة
1. ما هو التعريف العلمي الدقيق للذرة، ولماذا تعتبر الوحدة البنائية الأساسية للعنصر؟
التعريف العلمي الدقيق للذرة (Atom) هو أنها أصغر وحدة من المادة تحتفظ بالخصائص الكيميائية المميزة للعنصر الكيميائي. تُعتبر الوحدة البنائية الأساسية لأن أي تقسيم إضافي للذرة إلى مكوناتها دون الذرية (البروتونات، النيوترونات، والإلكترونات) يؤدي إلى فقدان الهوية الكيميائية للعنصر. على سبيل المثال، ذرة من الذهب هي أصغر جسيم يمكن أن يوجد ويظل يُظهر خصائص الذهب مثل لونه، وقابليته للطرق، ومقاومته للتآكل. إذا تم تفكيك هذه الذرة، فإن البروتونات والإلكترونات الناتجة لم تعد “ذهباً”، بل هي مكونات أساسية يمكن أن توجد في أي ذرة أخرى. إن هوية العنصر تُحدد حصراً بعدد البروتونات في النواة (العدد الذري)، وهذا العدد هو خاصية متكاملة للذرة كوحدة واحدة. لذلك، فإن الذرة تمثل الحد الذي لا يمكن تجاوزه في التقسيم المادي مع الحفاظ على الخصائص الكيميائية.
2. إذا كانت الذرة تتكون في معظمها من فراغ، فلماذا تبدو المواد صلبة ولا يمكننا المرور من خلالها؟
هذه ملاحظة فيزيائية عميقة. على الرغم من أن النواة تشغل جزءاً ضئيلاً من حجم الذرة وتدور الإلكترونات في مساحة شاسعة حولها، فإن مفهوم “الفراغ” هنا ليس فراغاً مطلقاً. هذه المساحة تملؤها السحابة الإلكترونية، وهي منطقة احتمالية لوجود الإلكترونات سالبة الشحنة. عندما تقترب ذرة من أخرى، فإن السحابتين الإلكترونيتين لكلتا الذرتين تتنافران بقوة بسبب شحنتهما السالبة المتشابهة (قوة التنافر الكهروستاتيكي). هذه القوة هائلة على المستويات الذرية وتزداد بشكل كبير كلما اقتربت الذرات من بعضها. إن ما نشعر به على أنه “صلابة” أو “ملمس” ليس تلامساً مادياً بين نوى الذرات، بل هو في الواقع الإحساس بقوة التنافر الكهروستاتيكي الشديدة بين سحابات الإلكترونات لذرات سطح الجسم وسطح يدنا. هذه القوة تمنع الذرات من اختراق بعضها البعض في الظروف العادية، مما يعطي المادة مظهرها الصلب والمتماسك.
3. ما هي الأدوار المحددة لكل من البروتونات والنيوترونات والإلكترونات داخل الذرة؟
لكل جسيم دون ذري دور محدد وحيوي يساهم في هوية الذرة وسلوكها:
- البروتونات (Protons): دورها الأساسي هو تحديد هوية الذرة. عدد البروتونات في النواة، أو العدد الذري (Z)، هو ما يميز عنصراً عن آخر بشكل فريد. بالإضافة إلى ذلك، تساهم شحنتها الموجبة في جذب الإلكترونات السالبة وإبقائها مرتبطة بالذرة، كما تساهم بشكل كبير في كتلة الذرة.
- النيوترونات (Neutrons): دورها الرئيسي هو ضمان الاستقرار النووي. بما أنها متعادلة الشحنة، فهي لا تساهم في التجاذب الكهربائي مع الإلكترونات، لكنها تساهم في القوة النووية الشديدة التي تربط النيوكليونات (البروتونات والنيوترونات) معًا، متغلبة على التنافر الهائل بين البروتونات الموجبة. كما يحدد عددها نوع النظير (Isotope) للعنصر وتساهم بشكل كبير في كتلة الذرة.
- الإلكترونات (Electrons): دورها حصري تقريباً في تحديد السلوك الكيميائي للذرة. إنها الجسيمات المسؤولة عن تكوين الروابط الكيميائية. توزيعها في مستويات الطاقة، وخاصة عددها في الغلاف الخارجي (إلكترونات التكافؤ)، يحدد ما إذا كانت الذرة ستميل إلى فقدان أو اكتساب أو مشاركة الإلكترونات، وبالتالي يحدد مدى نشاطها الكيميائي ونوع الروابط التي يمكن أن تشكلها.
4. كيف يمكن لذرتين من نفس العنصر أن تمتلكا كتلتين مختلفتين؟
يمكن لذرتين من نفس العنصر أن تمتلكا كتلتين مختلفتين من خلال ظاهرة تُعرف بالنظائر (Isotopes). التعريف الأساسي للعنصر هو عدد البروتونات في نواته. طالما أن الذرتين تحتويان على نفس عدد البروتونات، فإنهما تنتميان إلى نفس العنصر. ومع ذلك، يمكن أن يختلف عدد النيوترونات في النواة. بما أن كتلة الذرة تتركز بشكل أساسي في نواتها (مجموع كتل البروتونات والنيوترونات)، فإن أي اختلاف في عدد النيوترونات سيؤدي إلى اختلاف في الكتلة الإجمالية للذرة. على سبيل المثال، تحتوي كل ذرات عنصر الكربون على 6 بروتونات. لكن نظير الكربون-12 يحتوي على 6 نيوترونات (الكتلة الإجمالية ≈ 12 وحدة كتلة ذرية)، بينما يحتوي نظير الكربون-14 على 8 نيوترونات (الكتلة الإجمالية ≈ 14 وحدة كتلة ذرية). كلاهما ذرة كربون ولهما نفس الخصائص الكيميائية تقريباً، لكنهما يختلفان في الكتلة والاستقرار النووي.
5. ما الذي يدفع الذرة إلى التفاعل وتكوين روابط كيميائية مع ذرات أخرى؟
الدافع الأساسي وراء التفاعلات الكيميائية هو ميل الذرات للوصول إلى حالة أكثر استقراراً من حيث الطاقة. وفقاً للنموذج الذري، يرتبط هذا الاستقرار بتكوين إلكتروني معين، تحديداً امتلاك غلاف إلكتروني خارجي ممتلئ (غلاف التكافؤ). تُعرف هذه الحالة المستقرة بـ “قاعدة الثمانيات” (Octet Rule) لمعظم العناصر، حيث تسعى الذرة لامتلاك ثمانية إلكترونات في غلافها الخارجي، مشابهة للتكوين الإلكتروني للغازات النبيلة الخاملة. لتحقيق هذا التكوين المستقر، تتفاعل الذرات عن طريق فقدان إلكترونات التكافؤ (في حالة الفلزات)، أو اكتساب إلكترونات لإكمال غلافها (في حالة اللافلزات)، أو مشاركة الإلكترونات مع ذرات أخرى (في الرابطة التساهمية). هذه العملية تقلل من الطاقة الكامنة الكلية للنظام، مما ينتج عنه تكوين جزيئات أو مركبات أكثر استقراراً من الذرات المنفردة.
6. ما هو الفرق الجوهري بين الرابطة الأيونية والرابطة التساهمية على المستوى الذري؟
الفرق الجوهري يكمن في كيفية تعامل إلكترونات التكافؤ بين الذرات المترابطة:
- الرابطة الأيونية (Ionic Bond): تتميز بالانتقال الكامل لإلكترون واحد أو أكثر من ذرة إلى أخرى. تحدث عادةً بين ذرة ذات كهرسلبية منخفضة (تميل لفقد الإلكترونات، مثل الفلزات) وذرة ذات كهرسلبية عالية (تميل لاكتساب الإلكترونات، مثل اللافلزات). الذرة التي تفقد الإلكترونات تصبح أيوناً موجب الشحنة (كاتيون)، والذرة التي تكتسبها تصبح أيوناً سالب الشحنة (أنيون). الرابطة نفسها هي قوة التجاذب الكهروستاتيكي القوية بين هذه الأيونات المتعاكسة الشحنة.
- الرابطة التساهمية (Covalent Bond): تتميز بمشاركة زوج أو أكثر من الإلكترونات بين نواتي ذرتين. تحدث عادةً بين ذرات لها كهرسلبية متقاربة (غالباً بين لافلزات). بدلاً من الانتقال، يتم احتواء الإلكترونات المشتركة في مدار جزيئي يحيط بكلتا النواتين، مما يربطهما معاً في وحدة واحدة هي الجزيء. هذه المشاركة تسمح لكل ذرة بالشعور بأن غلافها التكافؤي ممتلئ ومستقر.
7. لماذا يُوصف النموذج الحديث للذرة بأنه “كمومي” بدلاً من كونه نظاماً كوكبياً مصغراً؟
فشل النموذج الكوكبي (نموذج رذرفورد) لأنه وفقاً للفيزياء الكلاسيكية، فإن أي جسيم مشحون (مثل الإلكترون) يدور في مسار دائري يجب أن يشع طاقة باستمرار، مما يؤدي إلى تباطؤه وسقوطه في النواة في جزء من الثانية. النموذج الكمومي الميكانيكي يحل هذه المشكلة لأنه يتعامل مع الإلكترونات ليس كجسيمات ذات مسارات محددة، بل كموجات احتمالية. الخصائص الأساسية للنموذج الكمومي هي:
- تكميم الطاقة (Quantization): لا يمكن للإلكترونات أن تتخذ أي قيمة للطاقة، بل توجد فقط في مستويات طاقة محددة ومتقطعة.
- مبدأ عدم اليقين (Uncertainty Principle): من المستحيل تحديد موقع الإلكترون وزخمه بدقة في نفس الوقت.
- المدارات (Orbitals): بدلاً من المسارات، يصف النموذج مناطق ثلاثية الأبعاد حول النواة (المدارات) تمثل التوزيع الاحتمالي لوجود الإلكترون.
لذلك، النموذج الكمومي لا يصف “أين” يوجد الإلكترون، بل “أين من المرجح” أن يوجد، وهو وصف أكثر دقة وثباتاً لسلوك الذرة.
8. ما الفرق الرئيسي بين الطاقة المنبعثة من تفاعل كيميائي والطاقة المنبعثة من تفاعل نووي؟
الفرق الرئيسي يكمن في مصدر الطاقة ومقدارها.
- الطاقة الكيميائية: تنشأ من إعادة ترتيب الروابط بين الذرات، أي من التغيرات في طاقة إلكترونات التكافؤ. عندما تتكون روابط أقوى وأكثر استقراراً، يتم إطلاق الفرق في الطاقة. هذه الطاقات تكون صغيرة نسبياً وتقاس عادةً بالكيلوجول لكل مول.
- الطاقة النووية: تنشأ من التغيرات داخل نواة الذرة نفسها، مثل الانشطار (انقسام النواة) أو الاندماج (اتحاد النوى). هذه العمليات تحول جزءاً صغيراً من كتلة النواة إلى كمية هائلة من الطاقة وفقاً لمعادلة أينشتاين الشهيرة E=mc². لأن القوة النووية الشديدة التي تربط النواة أقوى بملايين المرات من القوى الكهروستاتيكية التي تربط الإلكترونات، فإن الطاقة المنبعثة من التفاعلات النووية أكبر بملايين المرات من الطاقة المنبعثة من التفاعلات الكيميائية لنفس الكمية من المادة.
9. هل من الممكن “رؤية” ذرة منفردة، وإذا كان الأمر كذلك، فكيف؟
لا يمكن “رؤية” ذرة منفردة باستخدام الميكروسكوبات الضوئية التقليدية لأن حجم الذرة (حوالي 0.1 نانومتر) أصغر بكثير من الطول الموجي للضوء المرئي (400-700 نانومتر). ومع ذلك، تم تطوير تقنيات متقدمة تسمح لنا بتصوير وتحديد مواقع الذرات الفردية. أبرز هذه التقنيات هي:
- المجهر النفقي الماسح (Scanning Tunneling Microscope – STM): يستخدم إبرة دقيقة جداً تمرر بالقرب من سطح المادة. من خلال قياس التيار الكهربائي “النفقي” الصغير بين الإبرة وسطح العينة، يمكن للجهاز رسم خريطة طبوغرافية لسطح المادة بدقة تصل إلى مستوى الذرة الفردية.
- مجهر القوة الذرية (Atomic Force Microscope – AFM): يستخدم طرفاً حاداً متصلاً برافعة مرنة “يتحسس” السطح. من خلال قياس انحراف الرافعة بسبب القوى بين الطرف وذرات السطح، يمكنه إنشاء صورة ثلاثية الأبعاد للذرات.
هذه التقنيات لا “ترى” الذرة بالمعنى البصري، بل “تستشعر” وجودها وترسم خريطة لمواقعها.
10. ما هو الأيون، وكيف يختلف عن الذرة المتعادلة؟
الأيون (Ion) هو ذرة (أو جزيء) اكتسبت شحنة كهربائية صافية نتيجة لفقدان أو اكتساب إلكترون واحد أو أكثر. أما الذرة المتعادلة، فهي تحتوي على عدد متساوٍ من البروتونات (موجبة الشحنة) والإلكترونات (سالبة الشحنة)، مما يجعل شحنتها الكلية صفراً.
الاختلافات الرئيسية هي:
- الشحنة الكهربائية: الذرة المتعادلة ليس لها شحنة صافية، بينما الأيون له شحنة موجبة (كاتيون) أو سالبة (أنيون).
- عدد الإلكترونات: في الكاتيون، عدد الإلكترونات أقل من عدد البروتونات. في الأنيون، عدد الإلكترونات أكبر من عدد البروتونات.
- السلوك الكيميائي والفيزيائي: الأيونات تتصرف بشكل مختلف تماماً عن ذراتها المتعادلة. فهي تنجذب إلى الحقول الكهربائية، وتتفاعل بقوة مع المذيبات القطبية مثل الماء، وتشكل روابط أيونية قوية، وهي مسؤولة عن توصيل الكهرباء في المحاليل.