قوى فان دير فالس: ما طبيعتها وكيف تؤثر في حياتنا اليومية؟
كيف تشكل التفاعلات الجزيئية الضعيفة أساس العديد من الظواهر الطبيعية؟
بقلم: بروفيسور جلال معتوق
أستاذ الكيمياء الفيزيائية بخبرة تزيد عن عشرين عاماً في دراسة التفاعلات الجزيئية والقوى بين الجزيئات، حاصل على درجة الدكتوراه من جامعة السوربون، ومتخصص في ميكانيكا الكم التطبيقية والديناميكا الحرارية الجزيئية.
تتحكم قوى خفية في سلوك المواد من حولنا، قوى لا نراها بالعين المجردة لكنها تحدد ما إذا كانت المادة غازًا أم سائلًا أم صلبًا عند درجة حرارة معينة. هذه القوى الضعيفة نسبيًا لكنها شديدة التأثير تشكل الأساس لفهم كثير من الظواهر الطبيعية والكيميائية التي نواجهها يوميًا.
المقدمة
لقد واجهت في بداية مسيرتي الأكاديمية سؤالًا محيرًا من أحد طلابي: لماذا يتكثف بخار الماء ليصبح سائلًا إذا كانت جزيئات الماء متعادلة كهربائيًا ولا تحمل شحنة؟ كان هذا السؤال البسيط مدخلًا لنقاش عميق حول طبيعة القوى التي تربط الجزيئات ببعضها دون أن تكون روابط كيميائية حقيقية. إن التفاعلات بين الجزيئات تحكمها مجموعة من القوى الكهربائية الضعيفة التي تُعرف بقوى فان دير فالس، وهي قوى ذات طبيعة فيزيائية بحتة تنشأ من التوزيع غير المنتظم للشحنات الكهربائية داخل الجزيء أو حوله.
تُعَدُّ هذه القوى مسؤولة عن كثير من الخصائص الفيزيائية للمواد، من نقطة الغليان إلى اللزوجة، ومن قابلية الذوبان إلى التوتر السطحي. بالإضافة إلى ذلك، فهي تلعب دورًا محوريًا في العمليات البيولوجية مثل طي البروتينات وتكوين الأغشية الخلوية، وكذلك في التطبيقات الصناعية كتصميم المواد اللاصقة والطلاءات. فما هي هذه القوى بالتحديد؟ وكيف تعمل رغم ضعفها النسبي؟
ما هي قوى فان دير فالس ولماذا سُميت بهذا الاسم؟
تمثل قوى فان دير فالس (Van der Waals forces) مجموعة من القوى الكهروستاتيكية الضعيفة التي تنشأ بين الجزيئات المتعادلة كهربائيًا أو بين أجزاء مختلفة من الجزيء الواحد. هذه القوى ليست روابط كيميائية حقيقية، بل هي تفاعلات فيزيائية ناتجة عن التوزيعات المؤقتة أو الدائمة للشحنات الكهربائية؛ إذ تنشأ من الطبيعة الكهربائية للمادة على المستوى الجزيئي. تختلف هذه القوى عن الروابط التساهمية أو الأيونية في كونها أضعف بكثير، لكنها مع ذلك كافية للتأثير على السلوك الفيزيائي للمواد بشكل ملحوظ.
سُميت هذه القوى نسبة إلى العالم الهولندي يوهانس ديدريك فان دير فالس (Johannes Diderik van der Waals) الذي قدم في عام 1873 معادلته الشهيرة لوصف سلوك الغازات الحقيقية. أدرك فان دير فالس أن افتراضين أساسيين في نموذج الغاز المثالي خاطئان: أن الجزيئات ليس لها حجم، وأنها لا تتفاعل مع بعضها البعض. لقد أثبت من خلال أبحاثه أن الجزيئات تشغل حيزًا من الفراغ وأن هناك قوى تجاذب ضعيفة تعمل بينها، حتى في حالة الغازات. كما أن هذا الاكتشاف أحدث ثورة في فهمنا لسلوك المواد، ومنح فان دير فالس جائزة نوبل في الفيزياء عام 1910 تقديرًا لإسهاماته العظيمة. من جهة ثانية، فتح هذا العمل الباب أمام أجيال من العلماء لدراسة التفاعلات بين الجزيئات بعمق أكبر، وأدى إلى فهم أفضل للخصائص الفيزيائية للمواد في حالاتها المختلفة.
كيف اكتشف العلماء وجود هذه القوى الخفية؟
القصة العلمية وراء اكتشاف قوى فان دير فالس تبدأ مع الملاحظات التجريبية التي أظهرت انحرافات واضحة عن قانون الغاز المثالي. في منتصف القرن التاسع عشر، لاحظ العلماء أن الغازات الحقيقية لا تتبع المعادلة البسيطة PV = nRT في جميع الظروف؛ إذ كانت هناك انحرافات ملحوظة خاصة عند الضغوط العالية ودرجات الحرارة المنخفضة. هذه الانحرافات كانت تشير إلى وجود تفاعلات بين الجزيئات لم تكن محسوبة في النموذج المثالي. فما هي طبيعة هذه التفاعلات يا ترى؟
عندما بدأ فان دير فالس عمله على هذه المشكلة، استخدم نهجًا رياضيًا مبتكرًا لتعديل معادلة الغاز المثالي. فقد أدخل عاملين تصحيحيين: الأول يحسب الحجم الفعلي الذي تشغله الجزيئات نفسها (معامل b)، والثاني يحسب قوى التجاذب بين الجزيئات (معامل a). المعادلة الجديدة أصبحت: (P + an²/V²)(V – nb) = nRT. بالمقابل، فإن التأكيد التجريبي لهذه القوى جاء لاحقًا من دراسات متعددة، منها تجارب التسييل التي أظهرت أن الغازات يمكن تحويلها إلى سوائل عند تطبيق الضغط وخفض درجة الحرارة، وهو ما لا يمكن تفسيره دون افتراض وجود قوى تجاذب بين الجزيئات. هذا وقد ساهمت قياسات اللزوجة والتوتر السطحي أيضًا في تأكيد وجود هذه القوى الخفية التي تعمل بين الجزيئات المتعادلة كهربائيًا.
ما هي الأنواع المختلفة لقوى فان دير فالس؟
تنقسم قوى فان دير فالس إلى ثلاثة أنواع رئيسة تختلف في آلية نشوئها وقوتها النسبية، لكنها جميعًا تشترك في كونها تفاعلات كهروستاتيكية ضعيفة. إن فهم هذه الأنواع المختلفة يساعدنا على تفسير سبب اختلاف خصائص المواد رغم تشابه تركيبها الكيميائي أحيانًا:
الأنواع الثلاثة لقوى فان دير فالس:
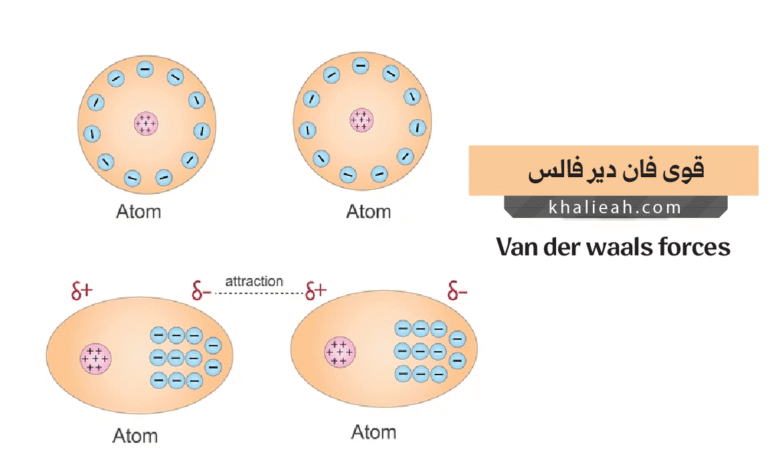
- قوى ثنائي القطب – ثنائي القطب (Dipole-Dipole Forces): تنشأ بين الجزيئات القطبية التي تمتلك عزمًا ثنائي قطب دائمًا؛ إذ يحدث توزيع غير متساوٍ للشحنات الكهربائية في الجزيء نتيجة اختلاف الكهروسالبية بين الذرات المكونة له، مما يخلق طرفًا موجبًا جزئيًا وطرفًا سالبًا جزئيًا، وتتجاذب هذه الأقطاب مع الأقطاب المعاكسة في الجزيئات المجاورة.
- قوى ثنائي القطب – ثنائي القطب المستحث (Dipole-Induced Dipole Forces): تحدث عندما يؤثر جزيء قطبي على جزيء غير قطبي مجاور له، فيتسبب المجال الكهربائي للجزيء القطبي في إعادة توزيع الإلكترونات في الجزيء غير القطبي بشكل مؤقت، مما يخلق ثنائي قطب مستحث أو مؤقت يتجاذب مع الجزيء القطبي الأصلي.
- قوى التشتت لندن (London Dispersion Forces): تُعَدُّ أضعف أنواع قوى فان دير فالس لكنها الأكثر عمومية؛ إذ توجد بين جميع الجزيئات سواء كانت قطبية أو غير قطبية، وتنشأ من التذبذبات اللحظية في توزيع الإلكترونات حول النواة، مما يخلق أقطابًا مؤقتة تستحث أقطابًا مماثلة في الجزيئات المجاورة.
من ناحية أخرى، تزداد قوة هذه التفاعلات بترتيب معين؛ فقوى ثنائي القطب – ثنائي القطب عادة ما تكون الأقوى بين الثلاثة (باستثناء الرابطة الهيدروجينية التي تُعَدُّ حالة خاصة منها)، تليها قوى ثنائي القطب المستحث، ثم قوى التشتت لندن. بينما تعتمد القوة الفعلية لكل نوع على عدة عوامل منها حجم الجزيء، وعدد الإلكترونات، ودرجة القطبية، والمسافة بين الجزيئات.
كيف تنشأ قوى التشتت لندن بين الجزيئات؟
قوى التشتت لندن تمثل ظاهرة كمومية رائعة تحدث حتى في أبسط الجزيئات غير القطبية. لقد كنت أشرح هذا المفهوم لطلابي في إحدى المحاضرات عندما طرح أحدهم سؤالًا: كيف يمكن لجزيئات الهيليوم أن تتكثف إلى سائل إذا كانت ذرات الهيليوم كروية تمامًا ومتماثلة وغير قطبية؟ الإجابة تكمن في الطبيعة الديناميكية للإلكترونات. فالإلكترونات في أي ذرة أو جزيء تتحرك باستمرار حول النواة، وفي أي لحظة معينة قد يكون توزيعها غير متماثل تمامًا. هذا التوزيع غير المتماثل اللحظي يخلق ثنائي قطب مؤقتًا أو لحظيًا (instantaneous dipole)، يستمر لجزء ضئيل جدًا من الثانية لكنه كافٍ لإحداث تأثير.
عندما ينشأ هذا القطب المؤقت في جزيء ما، فإن مجاله الكهربائي يؤثر على الجزيئات المجاورة؛ إذ يعيد ترتيب إلكتروناتها بحيث تكون أقطابها المستحثة في اتجاه يسمح بالتجاذب. وبالتالي يحدث تزامن أو ارتباط بين حركة الإلكترونات في الجزيئات المتجاورة، مما يؤدي إلى قوة تجاذب صافية رغم أن كل قطب فردي مؤقت وعشوائي. كما أن هذه القوى تزداد مع زيادة عدد الإلكترونات في الجزيء، وهذا يفسر لماذا تكون نقطة غليان البروم (Br₂) أعلى بكثير من نقطة غليان الفلور (F₂)، رغم أن كليهما جزيئات ثنائية الذرة غير قطبية. البروم يحتوي على إلكترونات أكثر، مما يجعل سحابته الإلكترونية أكثر قابلية للاستقطاب (polarizability)، وبالتالي تكون قوى التشتت لديه أقوى.
فهل يا ترى يمكن حساب هذه القوى الضعيفة؟ نعم، لقد طور العالم الألماني فريتز لندن (Fritz London) في عام 1930 نموذجًا كموميًا لحساب طاقة التفاعل الناتجة عن قوى التشتت. المعادلة تُظهر أن طاقة التفاعل تتناسب عكسيًا مع القوة السادسة للمسافة بين الجزيئات، مما يعني أن هذه القوى تضعف بسرعة شديدة مع زيادة المسافة. الجدير بالذكر أن قوى التشتت لندن موجودة في جميع المواد بلا استثناء، وفي المواد غير القطبية تكون هي القوة الوحيدة المسؤولة عن التماسك بين الجزيئات، مما يجعلها ذات أهمية بالغة في فهم سلوك الهيدروكربونات والغازات النبيلة والمواد العضوية غير القطبية.
ما الفرق بين قوى ثنائي القطب الدائم والمؤقت؟
التمييز بين الأقطاب الدائمة والمؤقتة يكمن في الطبيعة البنيوية للجزيء نفسه وليس في الظروف الخارجية. الجزيء القطبي يمتلك عزم ثنائي قطب دائم بسبب البنية الجزيئية غير المتماثلة واختلاف الكهروسالبية بين ذراته؛ إذ لا يمكن إلغاء هذا القطب إلا بكسر الجزيء نفسه. مثال كلاسيكي على ذلك هو جزيء الماء (H₂O)، فالأكسجين أكثر كهروسالبية من الهيدروجين بشكل واضح، والبنية المنحنية للجزيء (زاوية رابطة حوالي 104.5 درجة) تمنع إلغاء عزوم الروابط القطبية، مما ينتج عنه جزيء قطبي بشكل دائم مع شحنة سالبة جزئية على الأكسجين وشحنة موجبة جزئية على ذرتي الهيدروجين.
على النقيض من ذلك، الأقطاب المؤقتة أو المستحثة تنشأ في جزيئات غير قطبية في الأساس نتيجة لتأثيرات خارجية أو تذبذبات عشوائية. في حالة قوى التشتت لندن، يكون القطب ناتجًا عن التوزيع اللحظي غير المتماثل للإلكترونات، وهو يتغير باستمرار في الاتجاه والحجم خلال أجزاء ضئيلة من الثانية. بينما في حالة الأقطاب المستحثة بواسطة جزيئات قطبية، يستمر القطب المستحث طالما ظل الجزيء القطبي قريبًا؛ فبمجرد ابتعاد الجزيء القطبي، يعود الجزيء غير القطبي إلى حالته المتماثلة. ومما يميز هذا النوع من التفاعل أنه يعتمد على قابلية الاستقطاب للجزيء غير القطبي، وهي خاصية تقيس مدى سهولة تشويه السحابة الإلكترونية تحت تأثير مجال كهربائي خارجي.
لماذا تُعَدُّ قوى فان دير فالس ضعيفة مقارنة بالروابط الكيميائية؟
عندما نقارن قوى فان دير فالس بالروابط الكيميائية الحقيقية، نجد فرقًا هائلًا في طاقة الترابط. الرابطة التساهمية في جزيء الهيدروجين (H-H) تبلغ طاقتها حوالي 436 كيلوجول/مول، بينما طاقة قوى فان دير فالس بين جزيئات الهيدروجين لا تتجاوز 1 كيلوجول/مول تقريبًا. هذا الاختلاف الضخم – بنسبة تزيد عن 400 ضعف – يعكس الطبيعة المختلفة جذريًا لهذين النوعين من التفاعل؛ إذ تنطوي الروابط الكيميائية على تشارك أو نقل إلكترونات، مما يخلق تداخلًا قويًا بين الأغلفة الإلكترونية للذرات المترابطة، أما قوى فان دير فالس فهي مجرد تفاعلات كهروستاتيكية ضعيفة بين شحنات جزئية أو مؤقتة.
السبب الجوهري لهذا الضعف يعود إلى عدة عوامل. أولًا، قوى فان دير فالس تعمل بين جزيئات كاملة متعادلة كهربائيًا وليس بين أيونات مشحونة بشحنات كاملة. ثانيًا، المسافات بين الجزيئات عادة ما تكون أكبر بكثير من المسافات بين الذرات المترابطة كيميائيًا، والقوة الكهروستاتيكية تتناسب عكسيًا مع مربع المسافة (أو القوة السادسة في حالة قوى التشتت). إذاً فالجزيئات المتفاعلة عبر قوى فان دير فالس تبقى على مسافات نسبيًا كبيرة، مما يضعف التفاعل بشكل كبير. من جهة ثانية، فإن الطبيعة الجزئية أو المؤقتة للأقطاب المتفاعلة تعني أن القوة ليست مستمرة أو قوية كما في حالة الشحنات الكاملة. لكن رغم هذا الضعف النسبي، فإن العدد الهائل من هذه التفاعلات بين جزيئات كثيرة يمكن أن يؤدي إلى تأثير تراكمي ملحوظ جدًا، وهو ما يفسر قدرة الوزغ (gecko) على التسلق على الجدران الملساء باستخدام قوى فان دير فالس بين ملايين الشعيرات الدقيقة على أصابعه وسطح الجدار.
كيف تؤثر قوى فان دير فالس على نقاط الغليان والانصهار؟
تلعب قوى فان دير فالس دورًا حاسمًا في تحديد نقاط الانتقال الطورية للمواد، وخاصة المواد الجزيئية البسيطة. عندما نسخن مادة صلبة أو سائلة، فإننا نمد جزيئاتها بطاقة حركية تساعدها على التغلب على قوى التجاذب بينها؛ فكلما كانت هذه القوى أقوى، احتجنا إلى طاقة أكبر (أي درجة حرارة أعلى) لكسرها والانتقال من طور إلى آخر. هذه العلاقة المباشرة بين قوة التجاذب بين الجزيئات ونقاط الغليان والانصهار تجعل من السهل التنبؤ بالخصائص الفيزيائية للمواد بناءً على بنيتها الجزيئية.
العوامل التي تؤثر على نقاط الغليان والانصهار عبر قوى فان دير فالس:
- حجم الجزيء وعدد الإلكترونات: الجزيئات الأكبر حجمًا تمتلك إلكترونات أكثر وسحابة إلكترونية أكبر وأكثر قابلية للاستقطاب؛ وبالتالي تكون قوى التشتت لندن فيها أقوى، مما يرفع نقاط الغليان والانصهار، كما نلاحظ في سلسلة الهالوجينات: F₂ (غاز) < Cl₂ (غاز) < Br₂ (سائل) < I₂ (صلب) عند درجة حرارة الغرفة.
- شكل الجزيء ومساحة التماس: الجزيئات الخطية أو الممتدة لها مساحة تماس أكبر مع الجزيئات المجاورة مقارنة بالجزيئات الكروية أو المتفرعة؛ إذ تزداد قوى فان دير فالس مع زيادة مساحة التماس، فمثلًا البنتان الخطي (n-pentane) له نقطة غليان أعلى من الأيزوبنتان المتفرع رغم تطابق صيغتهما الجزيئية (C₅H₁₂).
- وجود قطبية دائمة: الجزيئات القطبية تمتلك قوى ثنائي القطب بالإضافة إلى قوى التشتت لندن؛ وعليه فإن مجموع القوى يكون أكبر، مما يرفع نقاط الانتقال الطوري بشكل ملحوظ، فمثلاً نقطة غليان الأسيتون القطبي (56°C) أعلى من نقطة غليان البنتان غير القطبي (36°C) رغم تقارب كتلتيهما الجزيئية.
لقد لاحظت خلال تجاربي في المختبر أن سلسلة الألكانات تقدم مثالًا ممتازًا لهذه العلاقة؛ فكلما زاد عدد ذرات الكربون في السلسلة، ارتفعت نقطة الغليان بشكل شبه خطي. هذا الارتفاع المنتظم يعكس الزيادة التدريجية في قوى التشتت لندن مع زيادة حجم الجزيء. وكذلك فإن المواد التي تكون غازات عند درجة حرارة الغرفة (مثل الميثان والإيثان) هي جزيئات صغيرة ذات قوى فان دير فالس ضعيفة جدًا، بينما الألكانات الأطول تكون سوائل أو حتى مواد صلبة شمعية عند نفس درجة الحرارة.
ما دور هذه القوى في الحياة اليومية والطبيعة؟
قوى فان دير فالس ليست مجرد مفهوم نظري محصور في الكتب الدراسية، بل هي قوى تؤثر في حياتنا اليومية بطرق متعددة ومدهشة. من اللحظة التي نستيقظ فيها صباحًا ونغسل وجوهنا بالماء، إلى لحظة نومنا على وسادة قطنية، نتعامل مع مواد وظواهر تحكمها هذه القوى الخفية؛ فما هي بعض التطبيقات والأمثلة العملية لقوى فان دير فالس في حياتنا؟
أمثلة عملية لقوى فان دير فالس في حياتنا:
- قدرة الوزغ والحشرات على التسلق: يستطيع الوزغ السير على الأسقف والجدران الزجاجية الملساء بفضل ملايين الشعيرات الدقيقة (setae) على أصابعه؛ إذ تخلق هذه الشعيرات مساحة تماس هائلة مع السطح، مما يولد قوى فان دير فالس تراكمية كافية لتحمل وزن الحيوان، وقد استلهم المهندسون من هذه الآلية الطبيعية لتطوير مواد لاصقة جديدة لا تترك أثرًا.
- خصائص البلاستيك والبوليمرات: البوليمرات مثل البولي إيثيلين والبولي بروبيلين هي جزيئات عملاقة غير قطبية تتماسك ببعضها بشكل رئيس عبر قوى التشتت لندن؛ وبالتالي فإن قوة وصلابة ومرونة هذه المواد تعتمد بشكل كبير على قوة هذه التفاعلات، والتي بدورها تتأثر بطول السلاسل البوليمرية ودرجة تفرعها.
- الأدوية وتفاعلها مع الجسم: كثير من الأدوية تعمل من خلال الارتباط بمستقبلات بروتينية في الجسم؛ إذ تساهم قوى فان دير فالس في استقرار هذا الارتباط بجانب أنواع أخرى من التفاعلات، مما يجعلها عاملًا مهمًا في تصميم الأدوية الجديدة وتحسين فعاليتها.
- تكثيف الغازات وإسالتها: الغازات الطبيعية والبترولية يتم إسالتها للنقل والتخزين باستخدام الضغط والتبريد؛ وعليه فإن هذه العملية تعتمد على استغلال قوى فان دير فالس لتقريب الجزيئات من بعضها وتحويلها من الحالة الغازية إلى السائلة، مما يقلل حجمها بشكل هائل ويسهل التعامل معها.
- البنية الثلاثية للبروتينات والحمض النووي: بالإضافة إلى ذلك، تساهم قوى فان دير فالس في تثبيت البنية الفراغية المعقدة للبروتينات والأحماض النووية؛ فالأجزاء غير القطبية من هذه الجزيئات العملاقة تتفاعل عبر قوى التشتت لندن، مما يساعد على طي البروتين في شكله الوظيفي النهائي.
أتذكر تجربة بسيطة أجريتها مع طلابي لإظهار تأثير قوى فان دير فالس: قمنا بمقارنة قابلية ذوبان الهيدروكربونات المختلفة في الماء وفي المذيبات العضوية. وجدنا أن الهيدروكربونات القصيرة تكون أكثر انحلالًا في الماء (ولو بشكل محدود) من الهيدروكربونات الطويلة، وهذا يعود إلى التوازن بين قوى التشتت لندن داخل طبقة الهيدروكربون وقوى التفاعل مع الماء. كما أن هذه التجربة البسيطة ساعدت الطلاب على فهم كيف تحدد قوى فان دير فالس سلوك الجزيئات في بيئات مختلفة.
كيف يمكن قياس قوة التجاذب بين الجزيئات؟
قياس قوى فان دير فالس بشكل مباشر يمثل تحديًا علميًا كبيرًا بسبب ضعفها الشديد ومداها القصير. لكن العلماء طوروا عدة تقنيات تجريبية ونظرية لتحديد قوة هذه التفاعلات بدقة متزايدة. من أكثر الطرق شيوعًا قياس طاقة التبخر (enthalpy of vaporization)، وهي الطاقة اللازمة لتحويل مول واحد من السائل إلى بخار عند نقطة الغليان؛ إذ تعكس هذه الطاقة مباشرة قوة القوى بين الجزيئات، فكلما كانت القوى أقوى، احتجنا طاقة أكبر لفصل الجزيئات عن بعضها. بالمقابل، فإن قياسات اللزوجة توفر أيضًا معلومات قيمة عن قوى التجاذب بين الجزيئات؛ فالسوائل ذات القوى الأقوى بين جزيئاتها تكون أكثر لزوجة لأن الجزيئات تقاوم الانزلاق بجانب بعضها البعض.
التقنيات الحديثة مثل مجهر القوة الذرية (Atomic Force Microscopy – AFM) أحدثت ثورة في قدرتنا على قياس قوى فان دير فالس بشكل مباشر على المستوى النانوي. يستخدم هذا المجهر إبرة دقيقة للغاية تقترب من سطح العينة وتقيس القوى المؤثرة عليها؛ وبالتالي يمكن من خلال تحليل منحنيات القوة-المسافة تحديد قوة التجاذب بين الإبرة والسطح، والتي تهيمن عليها قوى فان دير فالس في كثير من الحالات. وكذلك تُستخدم تقنيات الطيف الجزيئي المختلفة لدراسة التفاعلات بين الجزيئات؛ فمثلًا التحولات في خطوط الطيف الاهتزازي أو الدوراني للجزيء عند وجود جزيئات أخرى قريبة يمكن أن تكشف عن قوة ومدى التفاعلات بين الجزيئات.
من ناحية أخرى، تقدم الكيمياء الحسابية أدوات قوية لحساب طاقات التفاعل بين الجزيئات نظريًا؛ إذ تستخدم طرق الميكانيكا الكمومية المتقدمة مثل نظرية الاضطراب (perturbation theory) ونظرية الدالة الكثافة (Density Functional Theory – DFT) لحساب طاقة قوى فان دير فالس بدقة عالية. لقد عملت في السنوات الأخيرة مع فريق بحثي على استخدام محاكاة الديناميكا الجزيئية (Molecular Dynamics) لدراسة سلوك السوائل العضوية، ووجدنا توافقًا ممتازًا بين القيم المحسوبة والقياسات التجريبية لقوى فان دير فالس، مما يؤكد دقة النماذج النظرية الحديثة. إن هذه الأدوات الحسابية أصبحت لا غنى عنها في تصميم المواد الجديدة وفهم سلوك الأنظمة الجزيئية المعقدة.
هل يمكن للجزيئات غير القطبية أن تذوب في الماء؟
هذا السؤال يقودنا إلى أحد أشهر المبادئ في الكيمياء: “المشابه يذيب المشابه” (like dissolves like). الماء جزيء قطبي بشكل واضح ويشكل شبكة واسعة من الروابط الهيدروجينية القوية، وهذه الروابط أقوى بكثير من قوى التشتت لندن الموجودة بين الجزيئات غير القطبية؛ وعليه فإن إدخال جزيء غير قطبي في الماء يتطلب كسر بعض الروابط الهيدروجينية بين جزيئات الماء لإفساح مجال للجزيء الدخيل، لكن التفاعل الضعيف (قوى فان دير فالس) بين الجزيء غير القطبي والماء لا يعوض الطاقة المفقودة في كسر الروابط الهيدروجينية، مما يجعل العملية غير مواتية طاقيًا. إذاً فالجزيئات غير القطبية عمومًا لا تذوب في الماء بشكل جيد، وهذا ما نراه عندما نحاول خلط الزيت بالماء.
لكن هل هذا يعني أن الذوبانية معدومة تمامًا؟ الإجابة هي لا؛ فحتى الجزيئات غير القطبية لها قابلية ذوبان ضئيلة جدًا في الماء. مثلًا، الأكسجين والنيتروجين الموجودان في الهواء (وكلاهما جزيئات غير قطبية) يذوبان في الماء بكميات ضئيلة لكنها كافية لإبقاء الأسماك والكائنات المائية الأخرى على قيد الحياة. هذه الذوبانية المحدودة تحدث لأن الماء يمكنه استحثاث قطب ضعيف في الجزيئات غير القطبية، مما يخلق قوى ثنائي القطب-القطب المستحث، لكن هذه القوى تبقى أضعف بكثير من التفاعلات بين جزيئات الماء نفسها. بينما تزداد قابلية الذوبان إذا احتوى الجزيء على جزء قطبي وجزء غير قطبي (جزيء أمفيباثي amphipathic)؛ فالكحولات القصيرة مثل الإيثانول تذوب في الماء بشكل كامل رغم احتوائها على جزء هيدروكربوني غير قطبي، لأن المجموعة الهيدروكسيلية القطبية (-OH) تكون روابط هيدروجينية قوية مع الماء تعوض الطاقة المفقودة.
فما هي الآلية التي تجعل الجزيئات غير القطبية تتجنب الماء؟ الظاهرة تُعرف بالتأثير الكاره للماء (hydrophobic effect)، وهي في الواقع ليست ناتجة عن تنافر بين الماء والمادة غير القطبية، بل عن ميل جزيئات الماء للتفاعل مع بعضها البعض بقوة أكبر من تفاعلها مع الجزيئات غير القطبية. عندما تُجبر جزيئات الماء على الترتيب حول جزيء غير قطبي، فإنها تفقد جزءًا من حريتها الحركية، مما يقلل الإنتروبيا (العشوائية) في النظام، وهذا غير مفضل ثرموديناميكيًا. لذا تميل الجزيئات غير القطبية إلى التجمع مع بعضها البعض في الماء، مقللةً بذلك مساحة التماس مع الماء وزيادةً الإنتروبيا الكلية للنظام. هذا التأثير الكاره للماء يُعَدُّ من أهم القوى الدافعة لطي البروتينات وتكوين الأغشية الخلوية وتجميع الجزيئات في البيئات البيولوجية.
الخاتمة
لقد رأينا كيف أن قوى فان دير فالس، رغم ضعفها النسبي، تشكل عنصرًا جوهريًا في فهم سلوك المادة على المستوى الجزيئي. من تفسير سبب كون الماء سائلًا عند درجة حرارة الغرفة بينما الميثان غاز، إلى فهم كيف تلتصق الحشرات بالجدران وكيف تطوى البروتينات لتؤدي وظائفها الحيوية، هذه القوى الخفية تعمل بصمت لكن بتأثير عميق. إن إدراك أهمية قوى فان دير فالس يفتح أمامنا آفاقًا واسعة في تصميم المواد الجديدة، وتطوير الأدوية الفعالة، وفهم العمليات البيولوجية المعقدة. لقد كان شرف حياتي المهنية أن أشارك في هذا المجال الرائع من العلم، وأن أرى كيف تتحول المفاهيم النظرية المجردة إلى تطبيقات عملية تلمس حياة الناس.
ألا تجد أنه من المذهل كيف أن قوى بهذا الضعف يمكنها أن تحدث كل هذا التأثير في عالمنا؟ فما هي المادة أو الظاهرة من حولك التي ستنظر إليها الآن بعين جديدة مدركًا دور قوى فان دير فالس فيها؟
الأسئلة الشائعة
ما العلاقة بين قوى فان دير فالس والتوتر السطحي للسوائل؟
التوتر السطحي ينشأ مباشرة من عدم التوازن في قوى فان دير فالس؛ إذ أن الجزيئات الموجودة على سطح السائل تتعرض لقوى جذب من الجزيئات الموجودة أسفلها وبجانبها فقط، بينما لا توجد جزيئات فوقها، مما يخلق قوة صافية تسحبها نحو الداخل وتجعل السطح يتصرف كغشاء مرن. كلما كانت قوى فان دير فالس أقوى بين جزيئات السائل، زاد التوتر السطحي، وهذا يفسر لماذا يكون التوتر السطحي للزئبق عاليًا جدًا بينما يكون أقل في السوائل العضوية ذات القوى الأضعف.
هل تتأثر قوى فان دير فالس بدرجة الحرارة؟
نعم بالتأكيد؛ فارتفاع درجة الحرارة يزيد من الطاقة الحركية للجزيئات مما يجعلها تتحرك بسرعة أكبر وتتباعد عن بعضها. وبالتالي تضعف قوى فان دير فالس لأنها تتناسب عكسيًا مع المسافة بين الجزيئات. من جهة ثانية، فإن التذبذبات الحرارية العالية تقلل من فترة بقاء الأقطاب المؤقتة، مما يقلل من فعالية قوى التشتت لندن.
ما الفرق الجوهري بين قوى فان دير فالس والرابطة الهيدروجينية؟
الرابطة الهيدروجينية تُعَدُّ نوعًا خاصًا ومتطرفًا من قوى ثنائي القطب – ثنائي القطب، لكنها أقوى بكثير من قوى فان دير فالس العادية؛ إذ تنشأ عندما يرتبط الهيدروجين بذرة شديدة الكهروسالبية (كالأكسجين أو النيتروجين أو الفلور)، مما يخلق قطبًا قويًا جدًا وموجهًا بشكل محدد. طاقة الرابطة الهيدروجينية تتراوح بين 10-40 كيلوجول/مول، وهي أقوى بحوالي 10 أضعاف من قوى فان دير فالس العادية التي تتراوح بين 0.5-2 كيلوجول/مول. بالإضافة إلى ذلك، فإن الرابطة الهيدروجينية تمتلك توجيهية مكانية محددة (directional) بينما قوى فان دير فالس ليست موجهة بشكل صارم. هذا الفرق يجعل الرابطة الهيدروجينية مسؤولة عن خصائص فريدة للماء مثل الكثافة غير العادية للثلج وارتفاع نقطة غليان الماء بشكل استثنائي مقارنة بجزيئات مشابهة في الحجم.
كيف تُستغل قوى فان دير فالس في تقنيات النانو الحديثة؟
في عالم النانو، تصبح قوى فان دير فالس ذات أهمية هائلة لأن نسبة مساحة السطح إلى الحجم تكون عالية جدًا؛ وعليه فإن المواد النانوية تعتمد بشكل كبير على هذه القوى في خصائصها. تُستخدم هذه القوى في التجميع الذاتي (self-assembly) للجزيئات النانوية لتكوين بنى منظمة، وفي تثبيت أنابيب الكربون النانوية في المواد المركبة، وفي تصميم أجهزة استشعار نانوية فائقة الحساسية. كما أن تطبيقات مجهر القوة الذرية والمعالجة على المستوى النانوي تعتمد على التحكم الدقيق في قوى فان دير فالس بين رأس المجهر والعينة.
كيف يمكن حساب طاقة قوى فان دير فالس رياضيًا؟
لكل نوع من قوى فان دير فالس معادلة خاصة لحساب طاقة التفاعل. قوى ثنائي القطب – ثنائي القطب تُحسب بالمعادلة: E ∝ -μ₁²μ₂²/(kT·r⁶)، إذ μ يمثل عزم ثنائي القطب، k ثابت بولتزمان، T درجة الحرارة المطلقة، و r المسافة بين الجزيئات. بينما قوى التشتت لندن تُحسب بمعادلة لندن: E = -(3/4)·(α₁α₂)/(r⁶)·(I₁I₂)/(I₁+I₂)، إذ α تمثل قابلية الاستقطاب و I طاقة التأين الأولى. ومما يلاحظ في جميع الحالات أن الطاقة تتناسب عكسيًا مع القوة السادسة للمسافة (r⁶)، مما يعني أن هذه القوى قصيرة المدى جدًا وتضعف بسرعة مع زيادة المسافة بين الجزيئات.





