الروابط الكيميائية: ما الذي يجعل المواد تتماسك؟
كيف تتشكل الروابط بين الذرات وما أنواعها المختلفة؟
تُشكّل المادة من حولنا منظومة معقدة من الذرات المترابطة، فمن الماء الذي نشربه إلى الهواء الذي نتنفسه، تتحكم قوى غير مرئية في تماسك هذه الجزيئات وتحديد خصائصها الفيزيائية والكيميائية. إن فهم الآليات التي تربط الذرات ببعضها البعض يُعَدُّ حجر الأساس في علم الكيمياء الحديثة.
المقدمة
لقد شغل السؤال عن طبيعة المادة وتركيبها عقول العلماء منذ قرون طويلة، ومع تطور المعرفة العلمية أدركنا أن الذرات لا تبقى منعزلة في الطبيعة؛ إذ تميل إلى الارتباط مع ذرات أخرى لتشكيل مركبات مستقرة. تمثل الروابط الكيميائية القوى الكهربائية التي تجذب الذرات لبعضها وتحافظ على تماسكها في جزيئات ومركبات. إن دراسة هذه الروابط لا تقتصر على الجانب النظري فحسب، بل تمتد لتشمل تطبيقات عملية واسعة في الصناعة والطب والتكنولوجيا.
من جهة ثانية، فإن التنوع الهائل في المواد الموجودة حولنا يعكس التنوع في أنواع الروابط وقوتها وترتيبها المكاني. بالإضافة إلى ذلك، فإن القدرة على التنبؤ بخصائص المواد من خلال فهم طبيعة الروابط التي تحتويها تُمكّن الكيميائيين من تصميم مواد جديدة بخصائص محددة تلبي احتياجات مختلفة.
ما هي الروابط الكيميائية وما أهميتها؟
تُعرف الروابط الكيميائية بأنها القوى التي تربط الذرات ببعضها البعض لتكوين جزيئات أو بلورات، وهي ناتجة عن التفاعل بين الإلكترونات في الغلاف الخارجي للذرات. فما هي الأهمية الحقيقية لهذه الروابط في حياتنا اليومية؟ الإجابة تكمن في أن كل مادة نتعامل معها تدين بخصائصها الفريدة لنوع الروابط الموجودة فيها. فالماس مثلاً يُعَدُّ من أصلب المواد الطبيعية بسبب شبكة الروابط التساهمية القوية التي تربط ذرات الكربون فيه، بينما يتميز الملح بقابليته للذوبان في الماء نتيجة للروابط الأيونية بين أيونات الصوديوم والكلور.
كما أن فهم الروابط الكيميائية يُمكّننا من تفسير التفاعلات الكيميائية التي تحدث من حولنا باستمرار. عندما نشعل عود ثقاب، أو عندما نطبخ الطعام، أو حتى عندما نتنفس، فإننا نشهد عملية كسر روابط قديمة وتكوين روابط جديدة. لقد أتذكر تجربتي الأولى في مختبر الكيمياء بالمرحلة الثانوية عندما أضفنا حمض الهيدروكلوريك إلى كربونات الكالسيوم، ورأينا الفوران الشديد الناتج عن انطلاق غاز ثاني أكسيد الكربون؛ إذ كانت تلك اللحظة بمثابة إدراك حقيقي لقوة الروابط الكيميائية وكيفية تحولها.
لماذا تتكون الروابط الكيميائية بين الذرات؟
تسعى الذرات في الطبيعة إلى الوصول لحالة من الاستقرار الطاقي، وهي الحالة التي تكون فيها طاقة النظام في أدنى مستوياتها. هل سمعت من قبل بقاعدة الثمانيات (Octet Rule)؟ إنها المبدأ الذي ينص على أن الذرات تميل إلى امتلاك ثمانية إلكترونات في غلافها الخارجي لتصبح مستقرة مثل الغازات النبيلة. ولتحقيق هذا الاستقرار، تلجأ الذرات إلى تكوين روابط مع ذرات أخرى عبر مشاركة الإلكترونات أو نقلها أو حتى تشاركها بشكل حر كما في الفلزات.
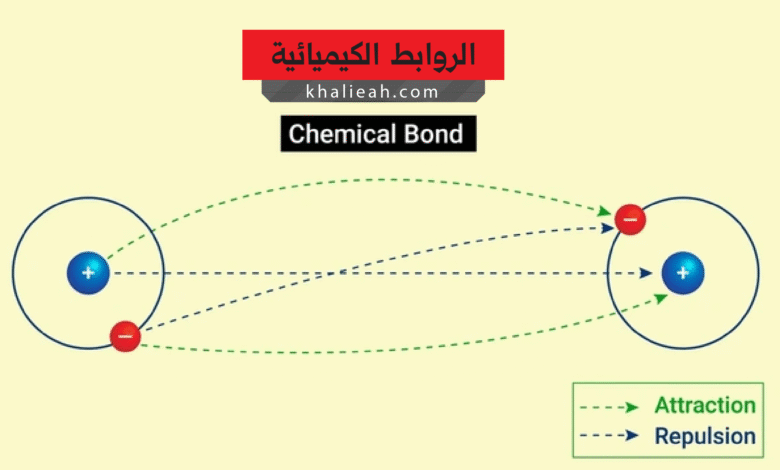
من ناحية أخرى، فإن القوى الكهروستاتيكية تلعب دوراً محورياً في تكوين هذه الروابط. تتجاذب الشحنات المختلفة وتتنافر الشحنات المتشابهة، وهذا المبدأ البسيط يفسر الكثير من سلوك الذرات عند الترابط. إن نواة الذرة الموجبة الشحنة تجذب الإلكترونات السالبة للذرات المجاورة، وفي الوقت نفسه تتنافر النوى الموجبة مع بعضها البعض. وعليه فإن الرابطة تتشكل عندما تتوازن قوى التجاذب والتنافر عند مسافة معينة تُسمى طول الرابطة (Bond Length)، وهي المسافة المثالية التي تحقق أدنى طاقة ممكنة للنظام.
ما الفرق بين الرابطة الأيونية والرابطة التساهمية؟
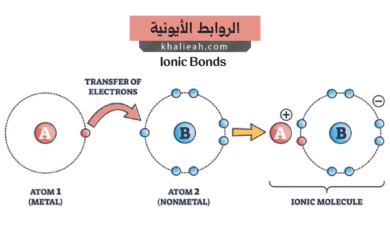
الرابطة الأيونية (Ionic Bond)
تتشكل الرابطة الأيونية عندما يحدث نقل كامل لإلكترون واحد أو أكثر من ذرة إلى أخرى، مما ينتج عنه أيونات موجبة وسالبة تتجاذب بقوة كهروستاتيكية. فهل يا ترى تعلم أن ملح الطعام الذي نستخدمه يومياً هو أبرز مثال على هذا النوع من الروابط؟ تتكون الرابطة الأيونية عادة بين الفلزات التي تفقد إلكترونات بسهولة واللافلزات التي تكتسب إلكترونات بسهولة. من أهم خصائص المركبات الأيونية:
- درجات انصهار وغليان عالية نتيجة القوة الكبيرة للروابط الأيونية
- القدرة على توصيل الكهرباء عند الذوبان في الماء أو الانصهار بسبب حركة الأيونات الحرة
- الصلابة والهشاشة في الحالة الصلبة بسبب الترتيب البلوري المنتظم
- قابلية الذوبان الجيدة في المذيبات القطبية مثل الماء
الرابطة التساهمية (Covalent Bond)
على النقيض من ذلك، تتكون الرابطة التساهمية عندما تتشارك ذرتان أو أكثر في أزواج من الإلكترونات بدلاً من نقلها. وبالتالي فإن هذا النوع من الروابط يسود بين اللافلزات التي لها قدرات متقاربة على جذب الإلكترونات. الجدير بالذكر أن جزيء الماء (H₂O) يحتوي على روابط تساهمية بين ذرة الأكسجين وذرتي الهيدروجين، وهو ما يمنح الماء خصائصه الفريدة التي تجعل الحياة ممكنة على كوكبنا. تتميز المركبات التساهمية بالخصائص التالية:
- درجات انصهار وغليان منخفضة نسبياً مقارنة بالمركبات الأيونية
- ضعف التوصيل الكهربائي في معظم الحالات
- إمكانية الوجود في حالات مختلفة (صلبة، سائلة، غازية) عند درجة حرارة الغرفة
- تنوع كبير في الخصائص الفيزيائية والكيميائية حسب نوع الذرات المرتبطة
بينما تُصنف الروابط التساهمية إلى أحادية وثنائية وثلاثية حسب عدد أزواج الإلكترونات المشتركة، فإن قوة الرابطة تزداد مع زيادة عدد هذه الأزواج. إذاً كيف نميز بين هذين النوعين من الروابط في الواقع؟ يعتمد ذلك بشكل رئيس على الفرق في الكهرسلبية (Electronegativity) بين الذرات المرتبطة؛ إذ إن الفرق الكبير يؤدي لتكوين روابط أيونية، بينما الفرق الصغير يؤدي لتكوين روابط تساهمية.
كيف تتشكل الرابطة الفلزية؟
تمثل الرابطة الفلزية (Metallic Bond) نوعاً فريداً من الروابط الكيميائية يوجد في الفلزات والسبائك المعدنية. إن طبيعة هذه الرابطة تختلف جوهرياً عن الروابط الأيونية والتساهمية؛ إذ تتميز بوجود بحر من الإلكترونات الحرة التي تتحرك بين أيونات الفلز الموجبة. فما هي الآلية الفعلية لهذا الترابط؟ عندما تتجمع ذرات الفلز معاً، تفقد كل ذرة إلكتروناتها الخارجية التي تصبح حرة الحركة في الشبكة البلورية، بينما تبقى الأيونات الموجبة في مواضع ثابتة نسبياً.
وكذلك فإن هذا النموذج الفريد يفسر الخصائص المميزة للفلزات مثل التوصيل الكهربائي والحراري الممتاز، واللمعان المعدني، والمطاطية والقابلية للطرق والسحب. لقد شاهدت ذات مرة حرفياً في سوق الذهب القديم بدمشق كيف يقوم الصائغ بطرق قطعة من الذهب وتشكيلها إلى حلي رقيقة دون أن تتكسر؛ إذ أدركت حينها أن هذه الخاصية الرائعة ناتجة عن طبيعة الرابطة الفلزية التي تسمح لطبقات الذرات بالانزلاق فوق بعضها دون كسر الروابط. بالمقابل، فإن المواد الأيونية تتحطم عند الطرق بسبب انزلاق الطبقات المشحونة بنفس الشحنة فوق بعضها مما يسبب تنافراً يؤدي للتكسر.
ما العوامل التي تحدد قوة الروابط الكيميائية؟
العوامل الذرية والجزيئية
تتأثر قوة الروابط الكيميائية بعدة عوامل مترابطة تحدد مدى متانة الرابطة ومقدار الطاقة اللازمة لكسرها. برأيكم ماذا يحدث عندما نغير حجم الذرات المرتبطة أو شحنتها؟ الإجابة هي أن هذه التغييرات تؤثر بشكل مباشر على قوة الرابطة واستقرارها. من أهم العوامل المؤثرة:
- حجم الذرات المرتبطة: كلما كانت الذرات أصغر حجماً، كانت المسافة بين النواة والإلكترونات المشتركة أقصر، مما يزيد من قوة الرابطة
- الشحنة النووية الفعالة: زيادة الشحنة الموجبة للنواة تزيد من جذبها للإلكترونات وبالتالي تقوي الرابطة
- عدد أزواج الإلكترونات المشتركة: الروابط الثلاثية أقوى من الثنائية التي هي بدورها أقوى من الأحادية
- طبيعة التهجين: نوع التهجين الإلكتروني (sp، sp²، sp³) يؤثر على طول الرابطة وقوتها
التأثيرات البيئية والهندسة الجزيئية
من ناحية أخرى، لا يمكن إغفال تأثير البيئة المحيطة بالجزيء على قوة روابطه. إن وجود روابط أخرى قريبة، والشكل الهندسي للجزيء، والتفاعلات بين الجزيئية كلها تلعب أدواراً في تحديد القوة النهائية للرابطة. كما أن ظاهرة الرنين (Resonance) في بعض الجزيئات تؤدي إلى توزيع الإلكترونات على عدة روابط، مما يجعل جميع هذه الروابط أقوى من الروابط الأحادية وأضعف من الثنائية. انظر إلى جزيء البنزين (C₆H₆) حيث تكون الروابط بين ذرات الكربون متماثلة بسبب الرنين، وهو ما يمنحه استقراراً استثنائياً.
ومما يجدر ذكره أن طاقة الرابطة (Bond Energy) تُقاس بكمية الطاقة اللازمة لكسر الرابطة في مول واحد من الجزيئات في الحالة الغازية. وبالتالي فإن الروابط ذات طاقة الرابطة الأعلى تُعَدُّ أكثر استقراراً وأصعب في الكسر، مما يفسر لماذا بعض المواد تحتاج لحرارة عالية جداً للتحلل بينما تتحلل مواد أخرى بسهولة عند درجات حرارة منخفضة.
كيف تؤثر الروابط الكيميائية على خواص المواد؟
تُعَدُّ الروابط الكيميائية المحدد الأول لجميع الخصائص الفيزيائية والكيميائية للمواد تقريباً. إذاً كيف يمكن لشيء غير مرئي بالعين المجردة أن يكون له هذا التأثير الكبير؟ السر يكمن في أن نوع الرابطة وقوتها وترتيبها الفراغي يحددون كيفية تفاعل المادة مع الطاقة الحرارية والكهربائية والضوء وحتى مع المواد الأخرى. فمثلاً، الألماس والجرافيت كلاهما مكون من ذرات الكربون فقط، لكن اختلاف ترتيب الروابط بينهما يجعل الأول أصلب مادة طبيعية معروفة بينما الثاني طري يُستخدم في أقلام الرصاص.
هذا وقد أثبتت الدراسات الحديثة أن فهم العلاقة بين البنية الجزيئية والخواص الفيزيائية مكّن العلماء من تصميم مواد جديدة بخصائص محددة مسبقاً. إن المواد البوليمرية الحديثة، والسبائك المعدنية عالية الأداء، وأشباه الموصلات المستخدمة في الإلكترونيات، كلها نتاج فهم عميق لكيفية تأثير الروابط الكيميائية على سلوك المواد. بالإضافة إلى ذلك، فإن الروابط الهيدروجينية (Hydrogen Bonds)، رغم ضعفها نسبياً مقارنة بالروابط التساهمية أو الأيونية، تلعب دوراً حاسماً في تحديد خصائص الماء الفريدة وفي الحفاظ على بنية البروتينات والأحماض النووية في الكائنات الحية.
الخاتمة
لقد استعرضنا في هذه المقالة الأسس العلمية للروابط الكيميائية وأنواعها المختلفة وكيفية تأثيرها على خصائص المواد من حولنا. إن فهم هذه الروابط لا يقتصر على كونه معرفة نظرية فحسب، بل يمثل مفتاحاً لفهم العالم المادي والتفاعلات التي تحدث فيه باستمرار. فقد تبين لنا أن كل مادة ندين لها بخصائصها الفريدة لطبيعة الروابط التي تربط ذراتها، من صلابة الألماس إلى سيولة الماء، ومن لمعان الذهب إلى شفافية الزجاج.
ومما لا شك فيه أن التقدم العلمي في مجال الكيمياء يعتمد بشكل كبير على الفهم المتزايد لطبيعة هذه الروابط وكيفية التحكم بها. إن التطبيقات العملية لهذا الفهم تمتد من تطوير أدوية جديدة لعلاج الأمراض، إلى ابتكار مواد صديقة للبيئة، وصولاً إلى تصميم تقنيات الطاقة المتجددة. وعليه فإن الاستثمار في دراسة الروابط الكيميائية وفهمها بعمق يمثل استثماراً في مستقبل البشرية وقدرتها على مواجهة التحديات المختلفة.
والآن، بعد أن تعرفت على الروابط الكيميائية وأنواعها وأهميتها، هل ستنظر إلى المواد من حولك بعين مختلفة؟ وهل ستتساءل عن طبيعة الروابط التي تجعل كل مادة فريدة في خصائصها؟