الجدول الدوري للعناصر: دليلك الشامل لفهم تنظيم المادة
رحلة علمية في أسرار العناصر الكيميائية وترتيبها المنطقي
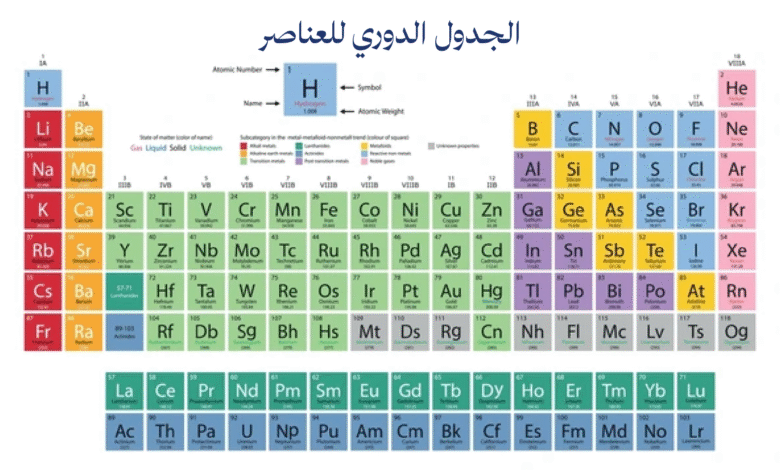
يمثل الجدول الدوري للعناصر أحد أعظم الإنجازات العلمية في تاريخ البشرية، حيث نجح في تنظيم كافة المواد الأساسية المكونة للكون في شكل منطقي ومنظم. هذا النظام الفريد يكشف عن العلاقات الخفية بين العناصر ويساعدنا على فهم طبيعة المادة وسلوكها الكيميائي بطريقة عميقة ومنهجية.
المقدمة
منذ فجر الحضارة الإنسانية، سعى العلماء والفلاسفة لفهم طبيعة المادة والعناصر التي تتكون منها. كان السؤال الأزلي حول ماهية الأشياء وكيفية تكوينها يشغل العقول لقرون طويلة. ومع تقدم العلوم الطبيعية، بدأ العلماء في اكتشاف عناصر جديدة وتحديد خصائصها المميزة، مما خلق حاجة ملحة لنظام تصنيف يجمع هذه العناصر بطريقة منطقية.
في هذا السياق، ظهر الجدول الدوري للعناصر ليحل هذه المعضلة العلمية الكبرى. لم يكن هذا الجدول مجرد قائمة عشوائية للعناصر، بل كان نظاماً عبقرياً يكشف عن العلاقات الداخلية بين العناصر المختلفة ويتنبأ بخصائص عناصر لم تُكتشف بعد. اليوم، يعتبر الجدول الدوري للعناصر حجر الأساس في علم الكيمياء الحديث، وأداة لا غنى عنها للطلاب والباحثين والعلماء في كافة التخصصات العلمية.
مفهوم الجدول الدوري وأهميته العلمية
يُعرّف الجدول الدوري للعناصر بأنه ترتيب منظم لجميع العناصر الكيميائية المعروفة بناءً على أعدادها الذرية وخصائصها الكيميائية والفيزيائية. هذا الترتيب ليس عشوائياً، بل يعكس القوانين الأساسية التي تحكم بنية الذرة وسلوكها. يحتوي الجدول على صفوف أفقية تسمى الدورات (Periods) وأعمدة رأسية تسمى المجموعات أو العائلات (Groups)، وكل موضع فيه يحمل معلومات قيمة عن العنصر المعني.
تكمن الأهمية الحقيقية للجدول الدوري للعناصر في قدرته على الكشف عن الأنماط المتكررة في خصائص العناصر. فالعناصر الموجودة في نفس المجموعة تشترك في خصائص كيميائية متشابهة، مما يسهل فهم سلوكها والتنبؤ بتفاعلاتها. هذه الدورية في الخصائص هي التي أعطت الجدول اسمه “الدوري”، حيث تتكرر الخصائص بشكل دوري كلما انتقلنا من عنصر لآخر.
علاوة على ذلك، يوفر الجدول الدوري للعناصر لغة مشتركة للعلماء حول العالم. فبدلاً من التعامل مع مئات العناصر بشكل فردي، يمكن للكيميائيين والفيزيائيين استخدام هذا النظام لفهم العلاقات بين العناصر والتنبؤ بسلوكها في ظروف مختلفة.
تاريخ تطوير الجدول الدوري
رحلة تطوير الجدول الدوري للعناصر كانت طويلة ومليئة بالجهود العلمية المتراكمة. في بداية القرن التاسع عشر، كان العلماء قد اكتشفوا حوالي 60 عنصراً، وبدأت المحاولات الأولى لتصنيفها. قام العالم الألماني يوهان دوبراينر (Johann Döbereiner) بملاحظة أن بعض العناصر يمكن تجميعها في ثلاثيات بناءً على خصائصها المتشابهة، وهو ما عُرف بقانون الثلاثيات.
لاحقاً، قدم العالم الإنجليزي جون نيولاندز (John Newlands) قانون الأوكتافات في عام 1865، حيث لاحظ أن العناصر عند ترتيبها حسب أوزانها الذرية تظهر تكراراً في الخصائص كل ثمانية عناصر، شبيهاً بالنغمات الموسيقية. رغم أن هذا القانون كان محدوداً ولم يشمل جميع العناصر، إلا أنه كان خطوة مهمة نحو فهم الدورية في خصائص العناصر.
الإنجاز الحقيقي جاء على يد العالم الروسي ديمتري مندليف (Dmitri Mendeleev) في عام 1869، الذي يُعتبر الأب الروحي للجدول الدوري للعناصر الحديث. قام مندليف بترتيب العناصر حسب أوزانها الذرية المتزايدة، مع ترك فراغات للعناصر التي لم تُكتشف بعد. الأمر المذهل أن مندليف تنبأ بخصائص هذه العناصر المفقودة بدقة ملحوظة، وعندما اكتُشفت لاحقاً، تطابقت خصائصها مع تنبؤاته بشكل كبير، مما أثبت صحة نظامه.
مع اكتشاف البنية الذرية وفهم العدد الذري في أوائل القرن العشرين على يد العالم هنري موزلي (Henry Moseley)، أُعيد تنظيم الجدول الدوري للعناصر ليعتمد على العدد الذري بدلاً من الوزن الذري. هذا التعديل حل العديد من التناقضات في جدول مندليف الأصلي وأعطانا الشكل الحديث للجدول الذي نستخدمه اليوم.
البنية الأساسية للجدول الدوري
يتكون الجدول الدوري للعناصر من 118 عنصراً معروفاً حتى الآن، موزعة على سبع دورات أفقية و18 مجموعة رأسية. كل عنصر في الجدول يُمثل بخانة خاصة تحتوي على رمزه الكيميائي (Chemical Symbol)، عدده الذري، وكتلته الذرية، بالإضافة إلى معلومات أخرى قد تختلف حسب تصميم الجدول. الرمز الكيميائي عادة ما يكون حرفاً واحداً أو حرفين مشتقين من الاسم اللاتيني أو الإنجليزي للعنصر.
العدد الذري (Atomic Number) هو العنصر الأساسي في ترتيب الجدول الدوري للعناصر الحديث، وهو يمثل عدد البروتونات في نواة الذرة. هذا العدد فريد لكل عنصر ولا يتغير، مما يجعله المعيار الأمثل للتصنيف. أما الكتلة الذرية (Atomic Mass)، فهي متوسط كتلة ذرات العنصر مع الأخذ في الاعتبار نظائره المختلفة، وتُقاس بوحدة الكتلة الذرية (amu).
ينقسم الجدول الدوري للعناصر إلى عدة أقسام رئيسة بناءً على خصائص العناصر. هناك الفلزات (Metals) التي تشكل الغالبية العظمى من العناصر وتقع في الجانب الأيسر والأوسط من الجدول، واللافلزات (Non-metals) التي تقع في الجانب الأيمن، وأشباه الفلزات (Metalloids) التي تقع على خط متعرج يفصل بين الفلزات واللافلزات. هذا التقسيم يساعد في فهم السلوك الكيميائي والفيزيائي للعناصر.
الدورات والمجموعات في الجدول
الدورات (Periods) في الجدول الدوري للعناصر هي الصفوف الأفقية السبعة، ويتراوح عدد العناصر في كل دورة من دورة لأخرى. الدورة الأولى تحتوي على عنصرين فقط (الهيدروجين والهيليوم)، بينما الدورة السابعة تحتوي على 32 عنصراً عند احتساب السلاسل الكيميائية. العناصر في نفس الدورة لها نفس عدد المستويات الإلكترونية (Energy Levels) أو الأغلفة الإلكترونية حول النواة.
كلما انتقلنا من اليسار إلى اليمين في نفس الدورة في الجدول الدوري للعناصر، يزداد العدد الذري بمقدار واحد، مما يعني إضافة بروتون واحد إلى النواة وإلكترون واحد إلى الأغلفة الخارجية. هذا التدرج يؤدي إلى تغيرات منتظمة في الخصائص الكيميائية والفيزيائية للعناصر، مثل الطاقة اللازمة لإزالة إلكترون، والميل الإلكتروني، والحجم الذري.
أما المجموعات (Groups) فهي الأعمدة الرأسية الـ 18 في الجدول الدوري للعناصر، وتُرقم من 1 إلى 18 حسب النظام الحديث. العناصر في نفس المجموعة تشترك في عدد الإلكترونات في المستوى الخارجي (Valence Electrons)، وهو ما يحدد خصائصها الكيميائية بشكل رئيس. لذلك، نجد أن عناصر المجموعة الواحدة تتصرف بطرق متشابهة في التفاعلات الكيميائية وتكوّن مركبات مشابهة.
العائلات الكيميائية في الجدول الدوري
المجموعات الرئيسة ذات الخصائص المميزة
تحتوي بنية الجدول الدوري للعناصر على عدة عائلات كيميائية تتميز بخصائص فريدة ومميزة:
- الفلزات القلوية (Alkali Metals): وهي عناصر المجموعة الأولى (باستثناء الهيدروجين)، وتشمل الليثيوم، الصوديوم، البوتاسيوم، الروبيديوم، السيزيوم، والفرانسيوم. تتميز بنشاطها الكيميائي العالي جداً وليونتها، وتتفاعل بعنف مع الماء لتكوين هيدروكسيدات قلوية.
- الفلزات القلوية الترابية (Alkaline Earth Metals): وهي عناصر المجموعة الثانية، وتضم البريليوم، المغنيسيوم، الكالسيوم، السترونشيوم، الباريوم، والراديوم. هذه العناصر أقل نشاطاً من الفلزات القلوية لكنها ما زالت نشطة كيميائياً.
- الهالوجينات (Halogens): وهي عناصر المجموعة 17، وتشمل الفلور، الكلور، البروم، اليود، والأستاتين. تتميز بنشاطها الكيميائي العالي كلافلزات، وتميل لتكوين أملاح عند تفاعلها مع الفلزات.
- الغازات النبيلة (Noble Gases): وهي عناصر المجموعة 18، وتضم الهيليوم، النيون، الأرجون، الكريبتون، الزينون، والرادون. تتميز باستقرارها الكيميائي الشديد ونادراً ما تتفاعل مع عناصر أخرى بسبب امتلائها الإلكتروني الكامل.
- الفلزات الانتقالية (Transition Metals): وهي العناصر الموجودة في المجموعات من 3 إلى 12، وتشمل معادن مهمة مثل الحديد، النحاس، الذهب، والفضة. تتميز بقدرتها على تكوين أيونات بشحنات مختلفة ومركبات ملونة.
هذا التصنيف في الجدول الدوري للعناصر يسهل على الدارسين فهم السلوك الكيميائي المتوقع لكل مجموعة من العناصر، ويوفر إطاراً منطقياً لدراسة التفاعلات الكيميائية.
الخصائص الدورية للعناصر
أحد أهم جوانب الجدول الدوري للعناصر هو إظهاره للخصائص الدورية، أي الخصائص التي تتغير بشكل منتظم ومتكرر عبر الدورات والمجموعات. من أبرز هذه الخصائص نجد نصف القطر الذري (Atomic Radius)، الذي يميل للتناقص من اليسار إلى اليمين في نفس الدورة بسبب زيادة الشحنة النووية الفعالة، بينما يزداد من الأعلى إلى الأسفل في نفس المجموعة بسبب إضافة مستويات إلكترونية جديدة.
طاقة التأين (Ionization Energy) هي خاصية دورية أخرى مهمة في الجدول الدوري للعناصر، وتمثل الطاقة اللازمة لإزالة إلكترون من ذرة غازية معتدلة. تزداد طاقة التأين عموماً من اليسار إلى اليمين في الدورة وتقل من الأعلى إلى الأسفل في المجموعة. هذا النمط يفسر لماذا تكون الغازات النبيلة في أقصى اليمين صعبة التفاعل، بينما الفلزات القلوية في أقصى اليسار شديدة النشاط.
الكهروسالبية (Electronegativity) هي ميل الذرة لجذب الإلكترونات في الرابطة الكيميائية، وهي تزداد من اليسار إلى اليمين في الدورة وتقل من الأعلى إلى الأسفل في المجموعة. الفلور هو أكثر العناصر كهروسالبية في الجدول الدوري للعناصر بأكمله. هذه الخاصية حاسمة في تحديد نوع الروابط الكيميائية التي ستتكون بين العناصر المختلفة.
تصنيف العناصر حسب خصائصها الفيزيائية والكيميائية
التقسيمات الأساسية في الجدول
يمكن تقسيم عناصر الجدول الدوري للعناصر إلى فئات متعددة بناءً على خصائصها:
- الفلزات: تشكل حوالي 75% من العناصر، وتتميز باللمعان المعدني، والقدرة على توصيل الحرارة والكهرباء، والقابلية للطرق والسحب. معظم الفلزات صلبة في درجة حرارة الغرفة (باستثناء الزئبق)، وتميل لفقد الإلكترونات في التفاعلات الكيميائية.
- اللافلزات: تقع في الجانب الأيمن من الجدول وتتميز بخصائص معاكسة للفلزات. لا تمتلك لمعاناً معدنياً (باستثناء اليود)، وضعيفة في توصيل الحرارة والكهرباء، وهشة في حالتها الصلبة. تميل لكسب الإلكترونات أو مشاركتها في التفاعلات.
- أشباه الفلزات: وهي عناصر انتقالية بين الفلزات واللافلزات، وتشمل البورون، السيليكون، الجرمانيوم، الزرنيخ، الأنتيمون، والتيليريوم. تمتلك خصائص وسطية بين الفلزات واللافلزات، مما يجعلها مهمة في صناعة أشباه الموصلات.
- العناصر الممثلة (Representative Elements): وهي عناصر المجموعات الرئيسة (1، 2، و13-18) في الجدول الدوري للعناصر، وتسمى أيضاً عناصر المجموعات الرئيسة. تتبع هذه العناصر قاعدة الثمانية في تكوين الروابط الكيميائية.
- العناصر الانتقالية الداخلية: وتشمل اللانثانيدات والأكتينيدات، وهي عناصر تُوضع عادة في صفين منفصلين أسفل الجدول الرئيس لتوفير المساحة. تتميز بخصائص معقدة وتشابه كبير بين عناصر نفس السلسلة.
هذا التصنيف المنهجي في الجدول الدوري للعناصر يسهل دراسة الكيمياء بشكل كبير، حيث يمكن التنبؤ بسلوك العنصر بمجرد معرفة موقعه في الجدول.
الإلكترونات والتوزيع الإلكتروني
يعتمد التنظيم الحديث للجدول الدوري للعناصر بشكل أساسي على التوزيع الإلكتروني (Electronic Configuration) للذرات. الإلكترونات تدور حول النواة في مستويات طاقة محددة تسمى الأغلفة الإلكترونية أو المدارات (Orbitals). كل مستوى طاقة يمكنه استيعاب عدد محدد من الإلكترونات وفقاً لقواعد ميكانيكا الكم.
المستوى الأول يستوعب إلكترونين كحد أقصى، والثاني ثمانية، والثالث 18، وهكذا. العناصر في الجدول الدوري للعناصر تُرتب بحيث تعكس امتلاء هذه المستويات بالإلكترونات. عند الانتقال من عنصر إلى الذي يليه، يُضاف إلكترون واحد إلى البنية الإلكترونية. التوزيع الإلكتروني للمستوى الخارجي هو الذي يحدد الخصائص الكيميائية للعنصر بشكل رئيس.
العناصر في نفس المجموعة في الجدول الدوري للعناصر لها نفس عدد الإلكترونات في المستوى الخارجي، مما يفسر تشابهها في السلوك الكيميائي. على سبيل المثال، جميع الفلزات القلوية لها إلكترون واحد في المستوى الخارجي، بينما الهالوجينات لها سبعة إلكترونات في المستوى الخارجي. هذا النمط يجعل من السهل التنبؤ بالتفاعلية الكيميائية للعناصر وأنواع الروابط التي ستكونها.
العدد الذري والكتلة الذرية
العدد الذري (Z) هو المفهوم المركزي في تنظيم الجدول الدوري للعناصر الحديث، وهو يساوي عدد البروتونات في نواة الذرة. هذا العدد فريد لكل عنصر ويحدد هويته الكيميائية. في الذرة المتعادلة كهربائياً، يساوي عدد البروتونات عدد الإلكترونات، مما يعني أن العدد الذري يحدد أيضاً عدد الإلكترونات في الذرة المتعادلة.
ترتيب العناصر في الجدول الدوري للعناصر يتبع تصاعد العدد الذري، بدءاً من الهيدروجين (Z=1) وانتهاءً بالأوغانيسون (Z=118). هذا الترتيب يضمن أن العناصر ذات الخصائص المتشابهة تقع في نفس المجموعات، وأن الدورية في الخصائص تظهر بشكل واضح ومنتظم. العدد الذري هو أساس التصنيف الحديث وقد حل المشاكل التي واجهت التصنيف القديم القائم على الوزن الذري.
أما الكتلة الذرية (A) أو الوزن الذري، فهي مجموع عدد البروتونات والنيوترونات في نواة الذرة. العناصر في الجدول الدوري للعناصر قد تمتلك نظائر مختلفة (Isotopes)، وهي ذرات لنفس العنصر لها نفس العدد الذري لكن أعداد مختلفة من النيوترونات، وبالتالي كتل ذرية مختلفة. الكتلة الذرية المدرجة في الجدول عادة ما تكون متوسطاً مرجحاً لكتل النظائر الطبيعية للعنصر بناءً على وفرتها في الطبيعة.
اللافلزات والفلزات وأشباه الفلزات
التقسيم بين الفلزات واللافلزات في الجدول الدوري للعناصر ليس حاداً تماماً، بل يوجد تدرج تدريجي في الخصائص. الفلزات تهيمن على الجانب الأيسر والأوسط من الجدول، وتشمل معادن معروفة مثل الحديد (Fe)، النحاس (Cu)، الذهب (Au)، والألمنيوم (Al). هذه العناصر تتميز بقدرتها على فقد الإلكترونات بسهولة لتكوين أيونات موجبة (Cations).
الفلزات في الجدول الدوري للعناصر تمتلك عدة خصائص فيزيائية مشتركة، منها اللمعان المعدني الذي يجعلها عاكسة للضوء، والقابلية للطرق (Malleability) والسحب (Ductility) التي تسمح بتشكيلها إلى صفائح أو أسلاك. كما أنها موصلات جيدة للحرارة والكهرباء بسبب وجود إلكترونات حرة الحركة في بنيتها. معظم الفلزات تمتلك نقاط انصهار وغليان عالية نسبياً، وكثافات عالية.
على الجانب الآخر، اللافلزات في الجدول الدوري للعناصر تقع في الزاوية اليمنى العليا، وتشمل عناصر حيوية مثل الكربون (C)، النيتروجين (N)، الأكسجين (O)، والكبريت (S). هذه العناصر تميل لكسب الإلكترونات لتكوين أيونات سالبة (Anions) أو لمشاركة الإلكترونات في روابط تساهمية. اللافلزات توجد في حالات مختلفة: غازية (مثل الأكسجين)، سائلة (مثل البروم)، أو صلبة (مثل الكبريت).
أشباه الفلزات تقع على الخط الفاصل بين الفلزات واللافلزات في الجدول الدوري للعناصر، وتمتلك خصائص وسطية. السيليكون (Si) والجرمانيوم (Ge) هما أشهر أمثلة أشباه الفلزات، ويُستخدمان على نطاق واسع في صناعة الإلكترونيات وأشباه الموصلات. هذه العناصر موصلات ضعيفة للكهرباء في درجة الحرارة العادية، لكن موصليتها تزداد مع ارتفاع درجة الحرارة، عكس الفلزات.
العناصر الانتقالية وخصائصها المميزة
العناصر الانتقالية (Transition Elements) تشكل جزءاً كبيراً من الجدول الدوري للعناصر، وتقع في المجموعات من 3 إلى 12 في وسط الجدول. تتميز هذه العناصر بخصائص فريدة تجعلها مهمة جداً في الحياة اليومية والصناعة. معظم العناصر الانتقالية فلزات صلبة ذات نقاط انصهار عالية وكثافات كبيرة، مثل التنجستن (W) الذي يمتلك أعلى نقطة انصهار بين جميع الفلزات.
ما يميز العناصر الانتقالية في الجدول الدوري للعناصر هو قدرتها على تكوين أيونات بحالات تأكسد متعددة (Multiple Oxidation States). على سبيل المثال، الحديد يمكن أن يكون Fe²⁺ أو Fe³⁺، والنحاس يمكن أن يكون Cu⁺ أو Cu²⁺. هذه المرونة في فقد عدد مختلف من الإلكترونات تجعل العناصر الانتقالية محفزات كيميائية ممتازة وتمكنها من المشاركة في تفاعلات معقدة.
خاصية مميزة أخرى للعناصر الانتقالية في الجدول الدوري للعناصر هي قدرتها على تكوين مركبات ملونة. هذه الألوان تنتج عن امتصاص أطوال موجية معينة من الضوء المرئي بواسطة الإلكترونات في المدارات d الجزئية المملوءة. مركبات النحاس غالباً زرقاء أو خضراء، ومركبات الكوبالت زرقاء، ومركبات النيكل خضراء، وهكذا. هذه الخاصية تُستخدم في الأصباغ، والدهانات، والأحجار الكريمة.
العناصر الانتقالية في الجدول الدوري للعناصر تكوّن أيضاً مركبات تناسقية معقدة (Complex Compounds) حيث تحيط بالأيون المركزي جزيئات أو أيونات أخرى تسمى الليجندات (Ligands). هذه المركبات مهمة في العمليات البيولوجية، مثل الهيموغلوبين الذي يحتوي على الحديد ويحمل الأكسجين في الدم.
السلاسل الكيميائية: اللانثانيدات والأكتينيدات
يحتوي الجدول الدوري للعناصر على سلسلتين كيميائيتين مهمتين تُوضعان عادة في صفين منفصلين أسفل الجدول الرئيس: اللانثانيدات (Lanthanides) والأكتينيدات (Actinides). هذا الترتيب ضروري للحفاظ على شكل الجدول مضغوطاً وسهل القراءة، لأن وضع هذه العناصر في مواضعها الطبيعية سيجعل الجدول عريضاً جداً وغير عملي.
اللانثانيدات، وتسمى أيضاً العناصر الأرضية النادرة (Rare Earth Elements)، هي سلسلة من 15 عنصراً تبدأ من اللانثانوم (La، العدد الذري 57) وتنتهي باللوتيتيوم (Lu، العدد الذري 71). على الرغم من اسمها، فإن هذه العناصر ليست نادرة جداً في القشرة الأرضية. في الجدول الدوري للعناصر، تتشابه اللانثانيدات بشكل كبير في خصائصها الكيميائية، مما يجعل فصلها عن بعضها صعباً جداً.
تُستخدم اللانثانيدات في تطبيقات تكنولوجية متقدمة، مثل المغناطيسات القوية (النيوديميوم)، والأجهزة الإلكترونية، والليزر، والمحفزات الكيميائية. اللانثانيدات في الجدول الدوري للعناصر تمتلك خواص مغناطيسية وبصرية فريدة تجعلها لا غنى عنها في الصناعات الحديثة.
الأكتينيدات هي سلسلة من 15 عنصراً تبدأ من الأكتينيوم (Ac، العدد الذري 89) وتنتهي باللورنسيوم (Lr، العدد الذري 103). جميع الأكتينيدات في الجدول الدوري للعناصر عناصر مشعة (Radioactive)، وبعضها لا يوجد طبيعياً بل يُنتج صناعياً في المفاعلات النووية أو المسرعات. أشهر الأكتينيدات هو اليورانيوم (U) الذي يُستخدم في الطاقة النووية والأسلحة النووية، والبلوتونيوم (Pu) الذي يُنتج في المفاعلات النووية.
خصائص الأكتينيدات في الجدول الدوري للعناصر معقدة بسبب النشاط الإشعاعي والتفاعلية الكيميائية العالية. هذه العناصر تتطلب احتياطات خاصة في التعامل معها بسبب خطورتها الإشعاعية. رغم ذلك، فإن بعض الأكتينيدات لها تطبيقات مهمة في الطب (مثل استخدام نظائر مشعة في التشخيص والعلاج)، وفي البحث العلمي، وفي توليد الطاقة.
العناصر الاصطناعية والعناصر فائقة الثقل
الجدول الدوري للعناصر لا يقتصر على العناصر الموجودة طبيعياً في الأرض والكون، بل يشمل أيضاً عناصر اصطناعية (Synthetic Elements) تم إنتاجها في المختبرات البحثية. هذه العناصر عادة ما تكون غير مستقرة ومشعة، وتتحلل بسرعة إلى عناصر أخف. العناصر التي لها أعداد ذرية أكبر من 92 (اليورانيوم) تسمى العناصر عبر اليورانيوم (Transuranium Elements)، وجميعها اصطناعية باستثناء بعض النظائر التي توجد بكميات ضئيلة جداً في الطبيعة.
إنتاج هذه العناصر في الجدول الدوري للعناصر يتطلب تقنيات متقدمة جداً، مثل قصف نوى ذرية ثقيلة بنوى أخرى أو بجسيمات مشحونة في مسرعات الجسيمات. العملية صعبة للغاية وتنتج عادة عدداً قليلاً جداً من الذرات، وأحياناً ذرة واحدة فقط في كل مرة. هذه الذرات تعيش لأجزاء من الثانية فقط قبل أن تتحلل، مما يجعل دراستها تحدياً كبيراً.
العناصر فائقة الثقل (Superheavy Elements) في الجدول الدوري للعناصر هي تلك التي لها أعداد ذرية أكبر من 104 تقريباً. أحدث العناصر المكتشفة والمعترف بها رسمياً هي: نيهونيوم (Nh، 113)، موسكوفيوم (Mc، 115)، تينيسين (Ts، 117)، وأوغانيسون (Og، 118)، والتي أُضيفت رسمياً إلى الجدول عام 2016. هذه العناصر سُميت تكريماً للعلماء أو الأماكن التي تم إنتاجها فيها.
رغم أن العناصر الاصطناعية في الجدول الدوري للعناصر قد لا تمتلك تطبيقات عملية مباشرة بسبب عدم استقرارها، إلا أن دراستها توسع فهمنا للبنية الذرية وقوى التماسك النووي. هناك نظريات تتنبأ بوجود “جزيرة الاستقرار” (Island of Stability) حيث قد تكون بعض النظائر الثقيلة جداً أكثر استقراراً من المتوقع، وهو ما يحفز الأبحاث المستمرة في هذا المجال.
أهمية الجدول الدوري في الحياة العملية والتطبيقات
المجالات الرئيسة لاستخدام الجدول
لا يقتصر الجدول الدوري للعناصر على كونه أداة تعليمية أو نظرية علمية، بل له تطبيقات عملية واسعة في حياتنا اليومية:
- الصناعة والتكنولوجيا: يستخدم المهندسون والصناعيون الجدول الدوري للعناصر لاختيار المواد المناسبة لكل تطبيق. على سبيل المثال، اختيار فلز معين لصناعة الأسلاك الكهربائية يعتمد على موصليته الكهربائية ومقاومته للتآكل، وهي معلومات يمكن استنتاجها من موقع العنصر في الجدول.
- الطب والصيدلة: العديد من العناصر في الجدول الدوري للعناصر ضرورية للصحة البشرية، مثل الكالسيوم للعظام، والحديد للدم، واليود للغدة الدرقية. كما تُستخدم نظائر مشعة من عناصر معينة في التصوير الطبي وعلاج السرطان.
- الزراعة: الأسمدة الكيميائية تحتوي على عناصر محددة من الجدول الدوري للعناصر مثل النيتروجين والفوسفور والبوتاسيوم (NPK)، والتي تعتبر أساسية لنمو النباتات. فهم خصائص هذه العناصر يساعد في تطوير أسمدة أكثر فعالية.
- حماية البيئة: معرفة خصائص العناصر المختلفة في الجدول الدوري للعناصر تساعد في فهم كيفية انتقال الملوثات في البيئة وكيفية معالجتها. على سبيل المثال، فهم سلوك المعادن الثقيلة السامة مثل الزئبق والرصاص ضروري لحماية الصحة العامة.
- البحث العلمي: يستخدم العلماء الجدول الدوري للعناصر كخريطة توجيهية في أبحاثهم، سواء في تطوير مواد جديدة، أو فهم التفاعلات الكيميائية، أو استكشاف عناصر جديدة. الجدول يوفر إطاراً منظماً لتصنيف المعرفة الكيميائية الهائلة.
- التعليم: الجدول الدوري للعناصر أداة تعليمية أساسية في جميع مراحل التعليم، من المدرسة الابتدائية إلى الجامعة. يساعد الطلاب على فهم العلاقات بين العناصر والتنبؤ بخصائصها وتفاعلاتها.
هذه التطبيقات المتنوعة تجعل من الجدول الدوري للعناصر أحد أهم الأدوات العلمية في العصر الحديث، وتبرز أهمية فهمه واستيعابه لكل من يعمل في المجالات العلمية والتقنية.
قراءة وفهم الجدول الدوري بفعالية
لكي يستفيد الدارس بشكل كامل من الجدول الدوري للعناصر، يحتاج إلى معرفة كيفية قراءته وتفسير المعلومات المتضمنة فيه. كل خانة في الجدول تحتوي على معلومات محددة عن العنصر: الرمز الكيميائي عادة ما يكون في المركز وبخط كبير، والعدد الذري عادة في الأعلى، والكتلة الذرية في الأسفل. بعض الجداول تتضمن معلومات إضافية مثل التوزيع الإلكتروني، ونصف القطر الذري، والكهروسالبية.
موقع العنصر في الجدول الدوري للعناصر يخبرنا بالكثير عن خصائصه دون الحاجة لحفظ معلومات مفصلة. العناصر في أقصى اليسار (المجموعة 1 والمجموعة 2) هي فلزات نشطة تفقد الإلكترونات بسهولة. العناصر في أقصى اليمين (المجموعة 17) هي لافلزات نشطة تكتسب الإلكترونات بسهولة. العناصر في أقصى اليمين تماماً (المجموعة 18) هي غازات نبيلة خاملة كيميائياً.
الألوان المختلفة المستخدمة في معظم نسخ الجدول الدوري للعناصر تساعد في التمييز بين فئات العناصر المختلفة. عادة ما تُلون الفلزات بلون واحد، واللافلزات بلون آخر، وأشباه الفلزات بلون ثالث. كما قد تُستخدم ألوان مختلفة للعناصر الانتقالية، واللانثانيدات، والأكتينيدات، والغازات النبيلة، مما يسهل التعرف عليها بسرعة.
فهم الاتجاهات (Trends) في الجدول الدوري للعناصر مهم جداً. بشكل عام، نصف القطر الذري يتناقص من اليسار إلى اليمين ويزداد من الأعلى إلى الأسفل. طاقة التأين والكهروسالبية تزدادان من اليسار إلى اليمين وتقلان من الأعلى إلى الأسفل. الصفة الفلزية تزداد من اليمين إلى اليسار ومن الأعلى إلى الأسفل. معرفة هذه الاتجاهات تمكن الدارس من التنبؤ بخصائص العناصر ومقارنتها.
التطورات الحديثة والمستقبل
الجدول الدوري للعناصر ليس ثابتاً بل يتطور باستمرار مع التقدم العلمي. آخر التحديثات الرسمية كانت في عام 2016 عندما أُضيفت أربعة عناصر جديدة لإكمال الدورة السابعة، مما جعل العدد الإجمالي للعناصر المعترف بها 118 عنصراً. هذه الإضافات تمثل إنجازات علمية كبيرة في مجال الفيزياء النووية، حيث استغرق إنتاج والتحقق من هذه العناصر سنوات من البحث المكثف.
الأبحاث الجارية حالياً تسعى لإنتاج عناصر أثقل تقع في الدورة الثامنة من الجدول الدوري للعناصر. هذا يمثل تحدياً تقنياً هائلاً، حيث أن إنتاج نوى ثقيلة جداً أصعب بكثير، والعناصر الناتجة قد تكون غير مستقرة للغاية وتتحلل خلال أجزاء من الثانية. مع ذلك، يواصل العلماء محاولاتهم، مدفوعين بالفضول العلمي والرغبة في فهم حدود البنية النووية.
مفهوم “جزيرة الاستقرار” يثير اهتماماً كبيراً في مجتمع الفيزياء النووية. تتنبأ النظريات بأن بعض النظائر الثقيلة جداً من عناصر في الجدول الدوري للعناصر قد تكون مستقرة نسبياً بسبب ترتيب معين للبروتونات والنيوترونات في نواتها. إذا تم اكتشاف هذه النظائر المستقرة نسبياً، فقد تكون لها تطبيقات غير متوقعة في المستقبل.
التطورات في تكنولوجيا الحوسبة الكمومية (Quantum Computing) وعلم المواد النانوية (Nanomaterials) تفتح آفاقاً جديدة لاستخدام المعلومات من الجدول الدوري للعناصر. الحواسيب الكمومية يمكنها محاكاة سلوك الذرات والجزيئات بدقة غير مسبوقة، مما قد يؤدي لاكتشاف مواد جديدة بخصائص مذهلة. وعلم المواد النانوية يستكشف كيف تتغير خصائص العناصر عندما تُقسم إلى جسيمات متناهية الصغر، وهو ما قد يتطلب توسيع فهمنا للجدول الدوري.
دور الجدول الدوري في التعليم الحديث
أصبح الجدول الدوري للعناصر جزءاً لا يتجزأ من المناهج الدراسية في جميع أنحاء العالم. لا يقتصر تدريسه على طلاب الكيمياء فقط، بل يشمل أيضاً طلاب الفيزياء، والأحياء، والهندسة، والطب، وحتى العلوم البيئية. هذا الانتشار الواسع يعكس الأهمية المحورية للجدول في فهم العلوم الطبيعية بشكل عام.
الأساليب التعليمية لتدريس الجدول الدوري للعناصر تطورت بشكل كبير في السنوات الأخيرة. بدلاً من الحفظ الأعمى للعناصر ورموزها، يركز التعليم الحديث على فهم المنطق وراء التنظيم والعلاقات بين العناصر. تُستخدم أدوات تفاعلية ومحاكاة حاسوبية وتجارب عملية لجعل التعلم أكثر متعة وفعالية.
الإنترنت ووسائل التكنولوجيا الحديثة وفرت موارد غنية لدراسة الجدول الدوري للعناصر. هناك نسخ تفاعلية عبر الإنترنت توفر معلومات تفصيلية عن كل عنصر، بما في ذلك صور، فيديوهات، تطبيقات عملية، وتاريخ اكتشافه. تطبيقات الهواتف الذكية تسمح للطلاب بحمل الجدول معهم والوصول إلى المعلومات في أي وقت.
أهمية الجدول الدوري للعناصر في التعليم تتجاوز مجرد تعلم الكيمياء. إنه يعلم الطلاب التفكير المنهجي، وتصنيف المعلومات، والبحث عن الأنماط، والتنبؤ بناءً على البيانات المتاحة. هذه مهارات أساسية قابلة للنقل إلى مجالات أخرى كثيرة. كما يوضح الجدول كيف يمكن للمعرفة العلمية أن تتطور وتتحسن بمرور الوقت، وهو درس مهم في طبيعة العلم نفسه.
الجدول الدوري والثقافة الشعبية
تجاوز تأثير الجدول الدوري للعناصر حدود المختبرات والفصول الدراسية ليصبح جزءاً من الثقافة الشعبية. يظهر الجدول في الأفلام، والمسلسلات التلفزيونية، والكتب، والألعاب، وحتى في التصميمات الفنية والديكور المنزلي. هذا الانتشار الثقافي يعكس مكانة الجدول كرمز للعلم والمعرفة في الوعي الجماعي.
في عام 2019، احتفل العالم بالذكرى المئوية الـ 150 لإنشاء الجدول الدوري للعناصر على يد مندليف، حيث أعلنت الأمم المتحدة ذلك العام “السنة الدولية للجدول الدوري للعناصر الكيميائية”. أقيمت فعاليات ومحاضرات ومعارض في مختلف أنحاء العالم للاحتفال بهذا الإنجاز العلمي العظيم وتعزيز الوعي العام بأهمية الكيمياء في حياتنا.
العديد من الفنانين والمصممين استلهموا من الجدول الدوري للعناصر في أعمالهم. يُستخدم الجدول في تصميمات القمصان، والملصقات، والأكواب، والمجوهرات، وحتى الأثاث. بعض المدارس والجامعات تزين جدرانها بنسخ كبيرة وملونة من الجدول. هذا الاستخدام الإبداعي يساعد في نشر الثقافة العلمية بطريقة جذابة ومحببة.
التحديات المعاصرة والنقاشات العلمية
رغم أن الجدول الدوري للعناصر مقبول عالمياً كأداة منظمة للعناصر، إلا أنه ليس خالياً من النقاشات والتحديات. أحد النقاشات المستمرة يتعلق بالشكل الأمثل للجدول. الشكل القياسي المستخدم حالياً، والمعروف بالشكل الطويل أو شكل IUPAC، ليس الشكل الوحيد الممكن. هناك أشكال بديلة مثل الجدول الحلزوني، والجدول الدائري، وأشكال ثلاثية الأبعاد، كل منها يبرز جوانب مختلفة من العلاقات بين العناصر.
نقاش آخر يتعلق بموضع بعض العناصر في الجدول الدوري للعناصر. على سبيل المثال، موضع الهيدروجين محل جدل، حيث يرى البعض أنه ينبغي وضعه في المجموعة 1 مع الفلزات القلوية، بينما يرى آخرون أنه ينبغي وضعه في المجموعة 17 مع الهالوجينات، أو حتى في موضع منفصل تماماً بسبب خصائصه الفريدة. كذلك هناك نقاش حول ما إذا كان ينبغي وضع اللانثانوم واللوتيتيوم، أو الأكتينيوم واللورنسيوم في المجموعة 3.
تسمية العناصر الجديدة في الجدول الدوري للعناصر تمثل أيضاً تحدياً ومجالاً للنقاش. هناك قواعد صارمة وضعها الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) لتسمية العناصر الجديدة. عادة ما تُسمى العناصر تكريماً لعلماء بارزين، أو أماكن جغرافية، أو خصائص مميزة، أو مفاهيم أسطورية. عملية اختيار الأسماء والرموز تتطلب موافقة دولية وقد تستغرق وقتاً طويلاً.
الخاتمة
يمثل الجدول الدوري للعناصر أحد أعظم الإنجازات الفكرية في تاريخ العلم، حيث نجح في تنظيم كل المادة المعروفة في الكون في نظام منطقي ومترابط. من خلال هذا النظام البسيط ظاهرياً والمعقد جوهرياً، يمكننا فهم العلاقات بين العناصر المختلفة والتنبؤ بخصائصها وسلوكها الكيميائي. الجدول الدوري للعناصر ليس مجرد قائمة للعناصر، بل هو خريطة للمادة تكشف عن القوانين الأساسية التي تحكم بنية الذرة وتفاعلاتها.
على مر السنين، تطور الجدول الدوري للعناصر من فكرة أولية إلى أداة علمية متقدمة تستخدم في كافة المجالات العلمية والتطبيقية. من التعليم إلى البحث العلمي، ومن الصناعة إلى الطب، يلعب الجدول دوراً محورياً في فهمنا للعالم من حولنا وفي تطوير تقنيات جديدة تحسن حياتنا. فهم الجدول الدوري للعناصر وإتقان قراءته يفتح الباب أمام فهم أعمق للكيمياء والعلوم الطبيعية بشكل عام.
مع استمرار التقدم العلمي والتكنولوجي، سيستمر الجدول الدوري للعناصر في النمو والتطور. قد نشهد اكتشاف عناصر جديدة، وتطوير أشكال جديدة للجدول، وفهماً أعمق للعلاقات بين العناصر. لكن الأساس الذي وضعه العلماء الرواد مثل مندليف سيظل قائماً، شاهداً على قدرة العقل البشري على إيجاد النظام في التعقيد واكتشاف القوانين الكونية التي تحكم المادة. الجدول الدوري للعناصر سيبقى دائماً رمزاً للتنظيم العلمي والفهم المنهجي، وأداة أساسية لكل من يسعى لفهم الأسرار الكيميائية للكون.