الوراثة: دليلك الشامل لفهم علم الجينات والصفات الموروثة
استكشاف آليات انتقال الصفات من الآباء إلى الأبناء وأسس علم الجينات

ملخص الإجابة
الوراثة (Genetics) هي العلم الذي يدرس آليات انتقال الصفات والخصائص البيولوجية من الكائنات الحية إلى نسلها عبر الجينات. تُحدد الوراثة الصفات الجسدية والوظيفية للكائن الحي من خلال الحمض النووي (DNA) المُنظَّم في كروموسومات. تتضمن قوانين مندل الأساسية السيادة والتنحي والتوزيع المستقل، وتُعد أساس فهم انتقال الأمراض الوراثية والتنوع البيولوجي.
هل تساءلت يوماً لماذا ورثت لون عينيك من جدتك بينما أخوك يشبه والدك تماماً؟ أو ربما يُقلقك احتمال نقل مرضٍ وراثي عائلي إلى أطفالك؟ أنت لست وحدك في هذه الحيرة. ملايين الآباء والأمهات يطرحون الأسئلة ذاتها كل يوم. المعرفة التي ستكتسبها من هذا الدليل ستمنحك فهماً حقيقياً لكيفية عمل جيناتك، وستُمكّنك من اتخاذ قرارات واعية بشأن صحتك وصحة عائلتك، سواء كنت تخطط لإنجاب طفل أو تريد فهم تاريخك الطبي العائلي.
ما هي الوراثة؟ مقدمة في علم الجينات
تعد الوراثة من أكثر المجالات العلمية إثارة للاهتمام لأنها تمس حياتنا اليومية بشكل مباشر، فهي تفسر سبب امتلاكنا لعيون بلون معين أو شعر بنمط محدد، كما تكشف عن أسباب بعض الأمراض التي تنتقل عبر الأجيال. يدرس علم الوراثة كيفية انتقال المعلومات البيولوجية من الكائنات الحية إلى نسلها، وكيف تتفاعل هذه المعلومات مع البيئة لإنتاج الخصائص المرئية والوظيفية للكائن الحي.
في أواخر القرن التاسع عشر، قام العالم النمساوي جريجور مندل بإجراء تجارب رائدة على نباتات البازلاء، حيث اكتشف قوانين أساسية تحكم انتقال الصفات الوراثية. أصبحت هذه التجارب حجر الأساس لفهمنا الحديث للوراثة، حيث أثبت مندل أن الصفات تنتقل عبر وحدات منفصلة أطلق عليها لاحقاً اسم “الجينات”. لم تحظ اكتشافات مندل بالاهتمام الكافي في حياته، لكن إعادة اكتشافها في القرن العشرين أدت إلى ثورة علمية حقيقية في مجال علم الأحياء.
مع تقدم الوقت، تطور علم الوراثة من مجرد ملاحظات بسيطة إلى علم دقيق يستخدم أحدث التقنيات الجزيئية. اليوم، يمكن للعلماء قراءة التسلسل الكامل للحمض النووي لأي كائن حي، وتحديد الجينات المسؤولة عن صفات معينة، بل وتعديل هذه الجينات لأغراض طبية وزراعية. هذا التقدم الهائل جعل من الوراثة علماً مركزياً يرتبط بمعظم المجالات الأخرى مثل علم المناعة والطب والزراعة.
الفرق بين الوراثة والبيئة
السؤال الذي يشغل الجميع
عندما يُولد طفل، يبدأ الأهل بالتساؤل: “على من سيكون شبيهًا؟ هل سيكون طويلًا مثل أبيه؟ هل سيكون ذكيًا مثل جده؟” هذه الأسئلة البسيطة تُخفي وراءها واحدًا من أعقد النقاشات العلمية.
ما الذي تُحدده الجينات؟ وما الذي تُشكّله البيئة؟
الوراثة (الجينات)
هي الصفات التي يرثها الطفل من والديه عبر الحمض النووي (DNA):
- لون العينين ← وراثي بنسبة كبيرة جدًا
- فصيلة الدم ← وراثية 100%
- بعض الأمراض ← مثل فقر الدم المنجلي
البيئة
هي كل ما يُحيط بالإنسان ويُؤثر فيه:
- التغذية
- التعليم
- الظروف الاقتصادية
- التجارب الحياتية
الحقيقة: معظم الصفات “مشتركة”!
| الصفة | دور الوراثة | دور البيئة |
|---|---|---|
| الطول | ~80% | ~20% (التغذية) |
| الذكاء | ~50-70% | ~30-50% (التعليم، التحفيز) |
| الوزن | ~40-70% | ~30-60% (النظام الغذائي، الرياضة) |
| الشخصية | ~40-50% | ~50-60% (التربية، التجارب) |
مثال مُبسَّط: الطول
تخيّل أن الجينات تُعطي طفلك “سقفًا” للطول (مثلاً: 175 سم كحد أقصى).
- إذا حصل على تغذية جيدة ← قد يصل إلى 175 سم
- إذا عانى من سوء التغذية ← قد يتوقف عند 165 سم
الجينات تُحدد الإمكانية، والبيئة تُحدد ما يتحقق فعلًا.
وماذا عن الذكاء؟
هذا السؤال الأكثر إثارة للجدل:
✅ نعم، للذكاء مكوّن وراثي — الدراسات على التوائم المتطابقة تُثبت ذلك
✅ لكن البيئة حاسمة — طفل بجينات “ذكية” في بيئة فقيرة تعليميًا قد لا يُظهر هذا الذكاء
الخلاصة:
الذكاء ليس “قدرًا جينيًا” — التحفيز المبكر، القراءة، التعليم الجيد، والتغذية السليمة كلها تصنع فرقًا حقيقيًا.
لماذا هذا الفهم مهم؟
| ❌ الفهم الخاطئ | ✅ الفهم الصحيح |
|---|---|
| “ابني غبي لأن جيناته كذا” | الجينات ليست حكمًا نهائيًا |
| “لا فائدة من المحاولة” | البيئة الجيدة تُفعّل أفضل ما في الجينات |
| “الوراثة = حتمية” | الوراثة = استعداد وإمكانية |
باختصار
صفات الإنسان = الجينات (البذرة) + البيئة (التربة والماء والشمس)
البذرة الجيدة تحتاج تربة جيدة لتُزهر، والتربة الممتازة لا تصنع شجرة من بذرة فاسدة.
المفاهيم الأساسية في الوراثة
لفهم الوراثة بشكل صحيح، يجب أولاً استيعاب مجموعة من المفاهيم الأساسية التي تشكل لغة هذا العلم. الجين (Gene) هو الوحدة الأساسية للوراثة، وهو عبارة عن قطعة من الحمض النووي تحمل معلومات لإنتاج بروتين معين أو أداء وظيفة محددة. تحتوي كل خلية في جسم الإنسان على نسختين من كل جين، نسخة من الأم ونسخة من الأب، وهذا ما يسمى بالأليلات (Alleles).
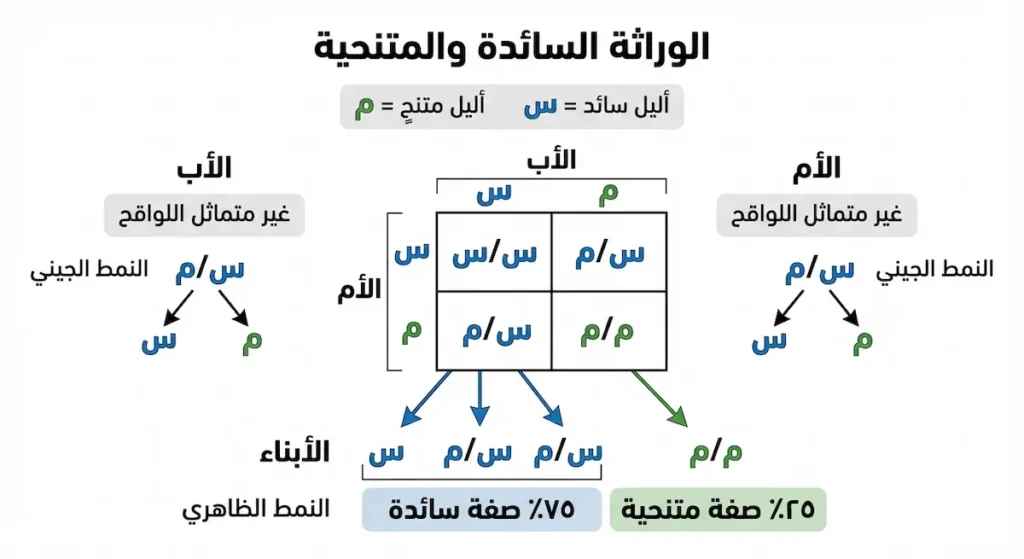
الأليلات هي أشكال مختلفة من نفس الجين، وقد تكون متماثلة أو مختلفة. عندما تكون الأليلات متماثلة، يسمى الفرد متماثل اللواقح (Homozygous)، وعندما تكون مختلفة، يسمى غير متماثل اللواقح (Heterozygous). تلعب العلاقة بين الأليلات دوراً حاسماً في تحديد الصفة الظاهرة، فبعض الأليلات تكون سائدة (Dominant) وتظهر صفتها حتى لو كانت موجودة بنسخة واحدة فقط، بينما تكون أليلات أخرى متنحية (Recessive) وتحتاج إلى نسختين لإظهار صفتها.
النمط الجيني (Genotype) يشير إلى التركيب الوراثي الفعلي للفرد، أي مجموعة الجينات التي يحملها. في المقابل، النمط الظاهري (Phenotype) هو التعبير الفعلي لهذه الجينات في شكل صفات مرئية أو قابلة للقياس. من المهم إدراك أن النمط الظاهري لا يتحدد بالنمط الجيني وحده، بل يتأثر أيضاً بالعوامل البيئية والتفاعلات المعقدة بين الجينات المختلفة، وهو ما يجعل دراسة الوراثة أكثر تعقيداً وإثارة.
| المصطلح العلمي | التعريف | مثال توضيحي |
|---|---|---|
| الجين (Gene) | الوحدة الأساسية للوراثة؛ قطعة من DNA تحمل تعليمات لإنتاج بروتين معين | جين OCA2 المسؤول عن لون العيون |
| الأليل (Allele) | الأشكال البديلة المختلفة من نفس الجين | أليل العيون الزرقاء وأليل العيون البنية |
| النمط الجيني (Genotype) | التركيب الوراثي الداخلي للفرد (الأليلات التي يحملها) | BB أو Bb أو bb |
| النمط الظاهري (Phenotype) | الصفات المرئية أو القابلة للقياس الناتجة عن التعبير الجيني | عيون بنية اللون |
| متماثل اللواقح (Homozygous) | امتلاك نسختين متطابقتين من الأليل لجين معين | BB (سائد) أو bb (متنحٍّ) |
| غير متماثل اللواقح (Heterozygous) | امتلاك نسختين مختلفتين من الأليل لجين معين | Bb (حامل للصفة المتنحية) |
| الأليل السائد (Dominant) | أليل يُظهر صفته حتى بوجود نسخة واحدة فقط | أليل العيون البنية (B) |
| الأليل المتنحي (Recessive) | أليل يحتاج إلى نسختين لإظهار صفته | أليل العيون الزرقاء (b) |
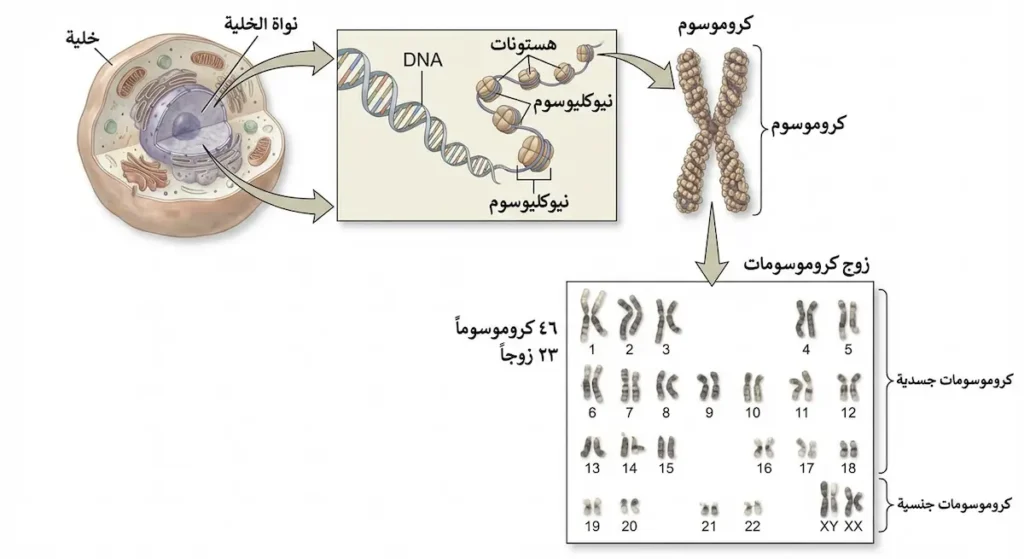
| الكروموسوم (Chromosome) | تركيب خيطي يحتوي على DNA ملفوف حول بروتينات الهستون | الإنسان يمتلك 46 كروموسوماً |
| الطفرة (Mutation) | تغيير دائم في تسلسل النيوكليوتيدات في DNA | استبدال قاعدة نيتروجينية بأخرى |
معلومة مذهلة:
إذا فككنا جميع خيوط DNA الموجودة في جسم إنسان واحد ووصلناها ببعضها، ستمتد لمسافة تصل إلى الشمس والعودة أكثر من 600 مرة! ومع ذلك، كل هذه المادة الوراثية مضغوطة داخل نواة خلية لا تُرى بالعين المجردة.
اقرأ أيضاً: الخلية (Cell): الوحدة الأساسية للحياة
الحمض النووي ودوره في الوراثة
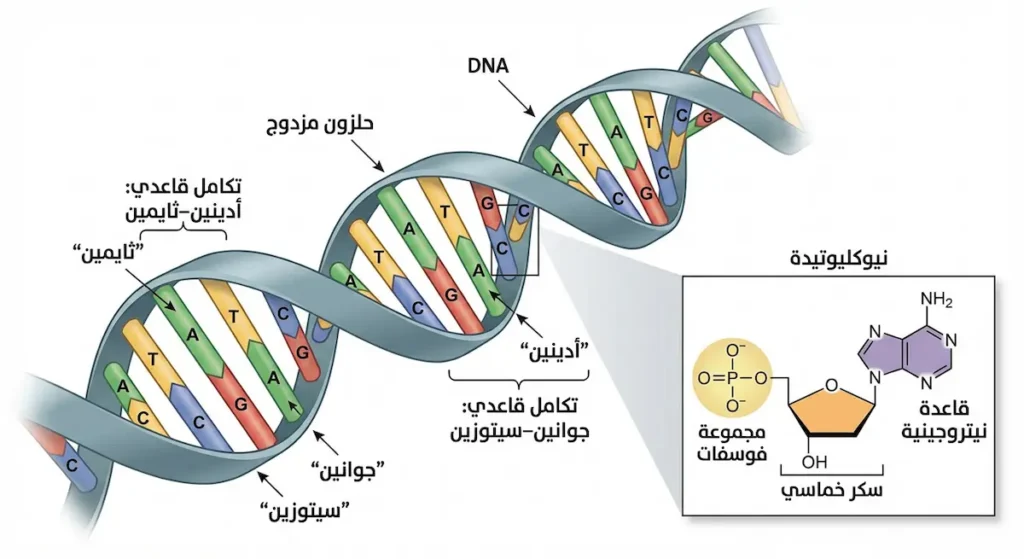
يعتبر الحمض النووي الريبوزي منقوص الأكسجين (DNA) الجزيء الأساسي الذي يحمل المعلومات الوراثية في معظم الكائنات الحية. يتكون DNA من سلسلتين ملتفتين حول بعضهما البعض في شكل حلزوني مزدوج، ويتألف من وحدات بنائية تسمى النيوكليوتيدات (Nucleotides). تحتوي كل نيوكليوتيدة على سكر خماسي، ومجموعة فوسفات، وقاعدة نيتروجينية. القواعد النيتروجينية الأربع في DNA هي: الأدينين (A)، والثايمين (T)، والجوانين (G)، والسيتوزين (C).
ترتبط هذه القواعد بطريقة محددة تسمى التكامل القاعدي، حيث يرتبط الأدينين دائماً مع الثايمين، بينما يرتبط الجوانين مع السيتوزين. هذه القاعدة الأساسية في البناء الجزيئي للحمض النووي تسمح بنسخ المعلومات الوراثية بدقة عالية عند انقسام الخلايا. تسلسل هذه القواعد النيتروجينية على طول جزيء DNA يشكل الشفرة الوراثية التي تحدد تكوين البروتينات وبالتالي جميع الخصائص الحيوية للكائن.
عملية تضاعف DNA تحدث قبل انقسام الخلية، حيث تنفصل السلسلتان عن بعضهما وتصبح كل منهما قالباً لبناء سلسلة جديدة مكملة. هذه العملية الدقيقة تضمن أن كل خلية جديدة تحصل على نسخة كاملة ومطابقة من المعلومات الوراثية. أي خطأ في هذه العملية قد يؤدي إلى طفرة، وهو ما سنتناوله بالتفصيل لاحقاً. يمكن للمهتمين بالتعمق في المعرفة العلمية حول بنية DNA الاطلاع على المصادر المتخصصة التي توضح التفاصيل الجزيئية الدقيقة.
حقيقة علمية:
يتشابه البشر جميعاً بنسبة 99.9% في تسلسل DNA الخاص بهم! الـ 0.1% المتبقي فقط هو ما يصنع كل الاختلافات المذهلة بيننا: من لون البشرة إلى الطول، ومن شكل الأنف إلى القابلية للإصابة بأمراض معينة.
اقرأ أيضاً: البيولوجيا الجزيئية: ما الذي يجعلها أساس فهم الحياة؟
آلية الوراثة: علاقة الجينات والكروموسومات
تنتظم الجينات في تراكيب خيطية تسمى الكروموسومات (Chromosomes)، وهي عبارة عن جزيئات DNA طويلة ملفوفة حول بروتينات خاصة تسمى الهستونات (Histones). في الخلايا البشرية، يوجد 46 كروموسوماً مرتبة في 23 زوجاً، 22 زوجاً منها تسمى الكروموسومات الجسدية (Autosomes)، والزوج الثالث والعشرون هو الكروموسومات الجنسية (Sex Chromosomes) التي تحدد جنس الفرد.
تحمل الكروموسومات الجنسية رموز X وY، حيث تمتلك الإناث زوجاً من كروموسومات X (XX)، بينما يمتلك الذكور كروموسوم X واحد وكروموسوم Y واحد (XY). هذا التنظيم الكروموسومي يعني أن الأب هو الذي يحدد جنس المولود، حيث يمكنه أن يورث كروموسوم X أو Y، بينما الأم تورث دائماً كروموسوم X. تحتوي الكروموسومات الجنسية على جينات مرتبطة بالجنس، وهذا يفسر لماذا بعض الأمراض الوراثية تصيب الذكور أكثر من الإناث أو العكس.
يقدر الباحثون أن الجينوم البشري يحتوي على حوالي 20,000 إلى 25,000 جين، لكن هذا الرقم يشكل نسبة صغيرة فقط من الحمض النووي الكلي. المناطق غير المشفرة في DNA كان يُعتقد أنها “حمض نووي غير مفيد”، لكن الأبحاث الحديثة أظهرت أن لها أدواراً تنظيمية مهمة. الجينات لا تعمل بشكل منعزل، بل تتفاعل مع بعضها البعض ومع البيئة بطرق معقدة، مما يخلق التنوع الهائل الذي نراه في الصفات البشرية والحيوانية والنباتية.
أنواع الوراثة: كيف تنتقل الصفات
الوراثة السائدة والمتنحية
تختلف أنماط انتقال الصفات الوراثية باختلاف طبيعة الجينات المسؤولة عنها، ويمكن تصنيف هذه الأنماط إلى عدة أنواع رئيسة:
- الوراثة السائدة الكاملة: في هذا النمط، يكفي وجود نسخة واحدة من الأليل السائد لإظهار الصفة المرتبطة به، حتى لو كان الأليل الآخر متنحياً. أمثلة ذلك تشمل صفة الشعر المجعد والقدرة على لف اللسان.
- الوراثة المتنحية: تتطلب وجود نسختين من الأليل المتنحي لإظهار الصفة، وهذا يعني أن الفرد يجب أن يكون متماثل اللواقح للأليل المتنحي. من أمثلة الأمراض الوراثية المتنحية مرض فقر الدم المنجلي والتليف الكيسي.
- السيادة غير الكاملة: في بعض الحالات، لا يسود أحد الأليلين بشكل كامل على الآخر، فينتج نمط ظاهري وسطي. مثال ذلك لون بعض الأزهار حيث يؤدي تزاوج نبات بأزهار حمراء مع نبات بأزهار بيضاء إلى نباتات بأزهار وردية.
- السيادة المشتركة: هنا يظهر كلا الأليلين في النمط الظاهري بشكل متساوٍ ومستقل، كما في فصائل الدم حيث يحمل الأشخاص من فصيلة AB كلاً من مستضد A ومستضد B على خلايا الدم الحمراء.
الوراثة المرتبطة بالجنس
تختلف الوراثة المرتبطة بالكروموسومات الجنسية عن الوراثة الجسدية في عدة جوانب مهمة. الجينات الموجودة على كروموسوم X تُورث بنمط خاص، حيث أن الذكور يمتلكون نسخة واحدة فقط من كروموسوم X، مما يجعلهم أكثر عرضة للإصابة بالأمراض المرتبطة بالجينات المتنحية على هذا الكروموسوم. عمى الألوان ومرض الهيموفيليا من أبرز الأمثلة على الأمراض المرتبطة بكروموسوم X.
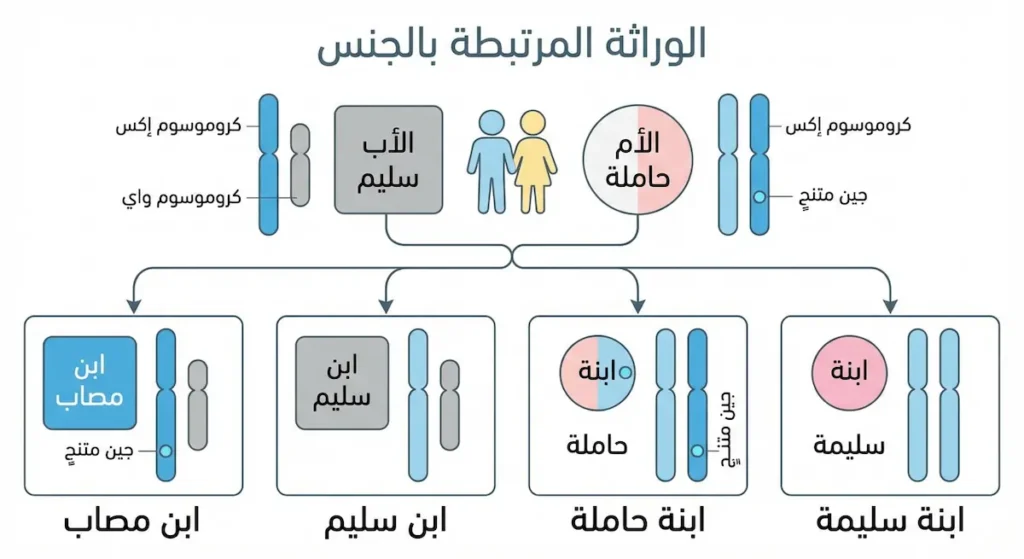
الإناث يحتجن إلى نسختين من الأليل المتنحي على كلا كروموسومي X لإظهار المرض، لكنهن قد يكن حاملات للمرض إذا كان لديهن نسخة واحدة فقط. الحاملات عادة لا تظهر عليهن أعراض المرض، لكنهن يمكن أن ينقلنه إلى أبنائهن الذكور. هذا النمط من الوراثة له آثار مهمة في الاستشارة الوراثية والتخطيط الأسري، حيث يساعد الأزواج على فهم احتمالات إنجاب أطفال مصابين بأمراض وراثية معينة.
اقرأ أيضاً: علم الأمراض (Pathology): دراسة الأمراض وتأثيرها على الجسم
الوراثة متعددة الجينات
العديد من الصفات البشرية مثل الطول والوزن ولون البشرة والذكاء لا تخضع لنمط وراثي بسيط يتحكم فيه جين واحد، بل تتأثر بتفاعل عدة جينات مختلفة، وهو ما يُعرف بالوراثة متعددة الجينات (Polygenic Inheritance). في هذا النمط، تساهم عدة جينات بدرجات متفاوتة في إنتاج الصفة النهائية، مما ينتج عنه توزيع مستمر للصفة بدلاً من فئات منفصلة.
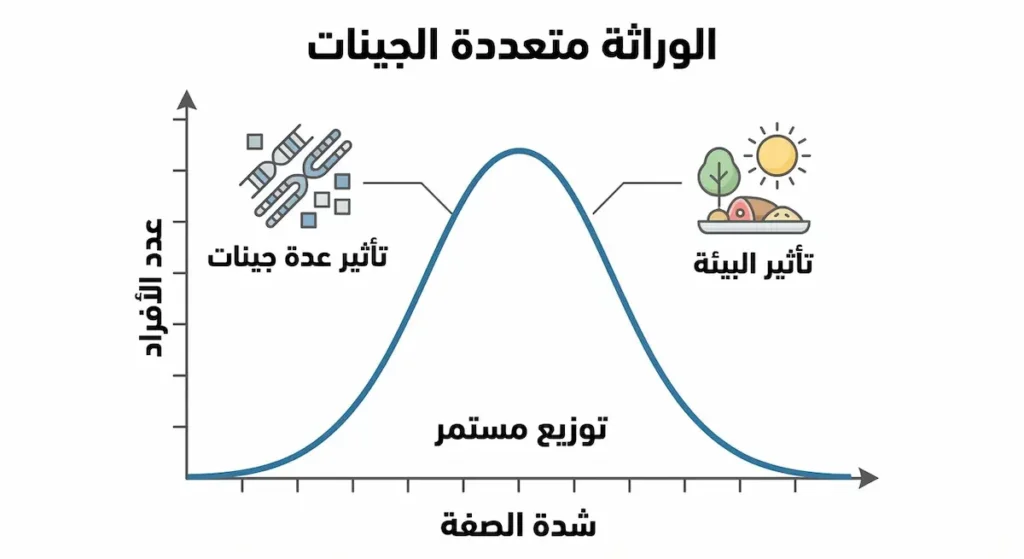
لون البشرة البشري مثال ممتاز على الوراثة متعددة الجينات، حيث يتحكم فيه ما لا يقل عن ثلاثة إلى ستة جينات مختلفة. هذا يفسر لماذا نرى طيفاً واسعاً من ألوان البشرة بدلاً من فئات محددة فقط. بالإضافة إلى التأثيرات الجينية، تلعب العوامل البيئية مثل التعرض للشمس دوراً في تحديد لون البشرة النهائي، مما يوضح التفاعل المعقد بين الوراثة والبيئة.
| نمط الوراثة | آلية الانتقال | احتمالية الظهور في النسل | أمثلة توضيحية |
|---|---|---|---|
| السائدة الكاملة | نسخة واحدة من الأليل السائد كافية لإظهار الصفة | 50% إذا كان أحد الوالدين حاملاً | الشعر المجعد، مرض هنتنغتون |
| المتنحية | نسختان من الأليل المتنحي مطلوبتان | 25% إذا كان كلا الوالدين حاملين | فقر الدم المنجلي، التليف الكيسي |
| السيادة غير الكاملة | لا يسود أي أليل بشكل كامل | نمط ظاهري وسطي بين الوالدين | لون أزهار فم السمكة (وردي) |
| السيادة المشتركة | كلا الأليلين يُعبَّر عنهما معاً | التعبير الكامل عن كليهما | فصيلة الدم AB |
| المرتبطة بكروموسوم X | الجين موجود على كروموسوم X | الذكور أكثر إصابة (نسخة واحدة) | عمى الألوان، الهيموفيليا |
| متعددة الجينات | عدة جينات تتفاعل معاً | توزيع مستمر للصفة | الطول، لون البشرة، الذكاء |
أغرب ما ستقرأه اليوم:
يمكن للأخطبوط تعديل مادته الوراثية أثناء حياته! على عكس معظم الكائنات الحية، تستطيع الأخطبوطات تحرير RNA الخاص بها للتكيف مع درجات حرارة المياه المتغيرة. هذه القدرة الفريدة جعلتها محل اهتمام العلماء الباحثين عن حلول للأمراض الوراثية البشرية.
الطفرات وتأثيرها على الصفات الوراثية
أنواع الطفرات الجينية
الطفرات (Mutations) هي تغييرات دائمة في التسلسل النيوكليوتيدي للحمض النووي، وهي تحدث بشكل طبيعي أو نتيجة للتعرض لعوامل خارجية. يصنف العلماء الطفرات إلى عدة أنواع رئيسة:
- طفرات نقطية: تحدث عندما يُستبدل نيوكليوتيد واحد بآخر في سلسلة DNA. قد تكون صامتة (لا تؤثر على البروتين الناتج)، أو خاطئة (تغير حمضاً أمينياً واحداً)، أو لا معنى لها (تُنتج إشارة توقف مبكرة).
- الإضافات والحذف: إضافة أو حذف نيوكليوتيد واحد أو أكثر، مما قد يسبب تغييراً في إطار القراءة (Frameshift Mutation) وينتج عنه بروتين معيب تماماً.
- طفرات كروموسومية: تشمل حذف أجزاء كبيرة من الكروموسوم، أو مضاعفتها، أو انقلابها، أو انتقالها إلى كروموسوم آخر، وغالباً ما يكون لها تأثيرات واسعة النطاق.
- طفرات جينية: قد تكون مفيدة في حالات نادرة، أو محايدة، أو ضارة. معظم الطفرات الضارة تُزال من خلال آليات الإصلاح الخلوية أو لا تنتقل إلى الأجيال التالية.
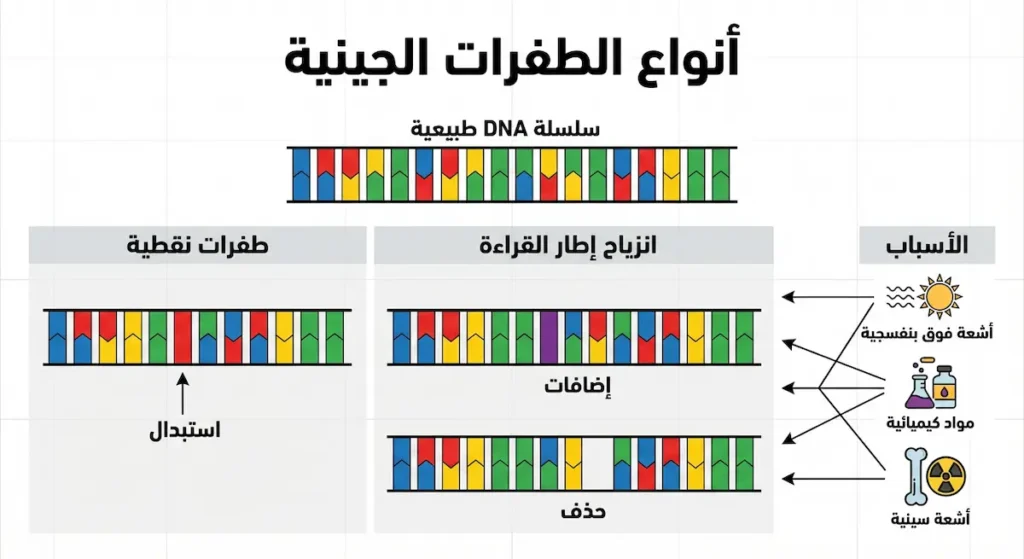
أسباب الطفرات
تحدث الطفرات نتيجة أخطاء عشوائية أثناء تضاعف DNA، رغم أن الخلايا تمتلك آليات تصحيح دقيقة. العوامل البيئية المطفرة مثل الأشعة فوق البنفسجية، والأشعة السينية، والمواد الكيميائية معينة تزيد من معدل حدوث الطفرات. كما أن بعض الفيروسات يمكنها إدخال DNA خاص بها في جينوم الخلية المضيفة، مما قد يسبب اضطرابات في الوظائف الجينية الطبيعية.
تختلف احتمالية الطفرات باختلاف مواقع الجينوم، فبعض المناطق تسمى “النقاط الساخنة” (Hot Spots) لأنها أكثر عرضة للتطفر من غيرها. العمر أيضاً عامل مهم، حيث تتراكم الطفرات في الخلايا مع التقدم في السن نتيجة التعرض المستمر للعوامل المطفرة وانخفاض كفاءة آليات الإصلاح. فهم آليات حدوث الطفرات وتأثيراتها أمر حيوي لتطوير علاجات للأمراض الوراثية والسرطانات.
الطفرات والتنوع الوراثي
رغم أن معظم الطفرات إما محايدة أو ضارة، فإنها المصدر الأساسي للتنوع الوراثي في المجموعات الحيوية. هذا التنوع ضروري لاستمرار الأنواع وقدرتها على التكيف مع التغيرات البيئية. الطفرات المحايدة تتراكم بمعدل ثابت نسبياً ويمكن استخدامها لتتبع العلاقات بين المجموعات السكانية والأنواع المختلفة.
في الخلايا الجسدية، قد تؤدي الطفرات إلى أمراض مثل السرطان، لكنها لا تنتقل إلى الأجيال التالية. أما الطفرات في الخلايا الجنسية (الحيوانات المنوية والبويضات)، فهي التي يمكن أن تورث للنسل وتساهم في التنوع الوراثي على مستوى الأجيال. دراسة الطفرات وتأثيراتها جزء أساسي من فهم الوراثة وكيفية عمل الجينات على المستويين الفردي والجماعي.
لمحة تاريخية:
عندما قدَّم غريغور مندل أبحاثه الثورية عام 1866، لم يحضر سوى 40 شخصاً تقريباً، ولم يفهم أحدٌ منهم أهمية ما اكتشفه! ظلت أبحاثه مهملة حتى أُعيد اكتشافها بعد وفاته بـ 16 عاماً، ليُلقَّب بعدها بـ “أبو علم الوراثة”.
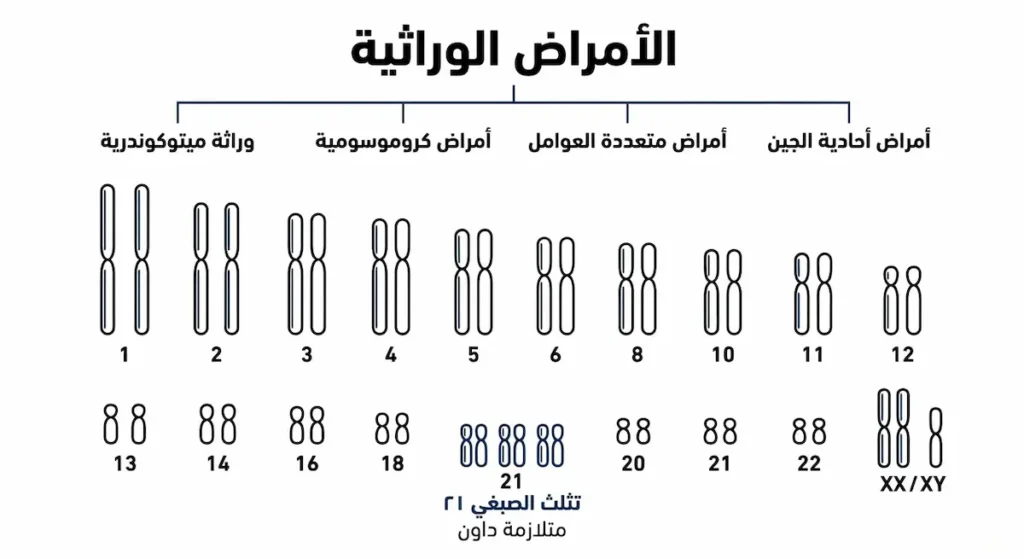
الأمراض الوراثية
تنتج الأمراض الوراثية عن اضطرابات في المادة الوراثية، وهي تتراوح من حالات بسيطة نسبياً إلى اضطرابات معقدة تؤثر على أجهزة متعددة في الجسم. يمكن تصنيف الأمراض الوراثية إلى عدة فئات رئيسة بناءً على آلية الوراثة وطبيعة الخلل الجيني. الأمراض أحادية الجين تنتج عن طفرة في جين واحد، وتتبع أنماط وراثية مندلية واضحة، مثل فقر الدم المنجلي الذي ينتج عن طفرة في جين الهيموغلوبين.
الأمراض الكروموسومية تحدث عندما يكون هناك خلل في عدد أو بنية الكروموسومات. متلازمة داون هي أشهر مثال، حيث يمتلك المصاب نسخة إضافية من الكروموسوم 21، مما يؤدي إلى مجموعة من السمات الجسدية والإدراكية المميزة. متلازمة تيرنر ومتلازمة كلاينفلتر أمثلة على اضطرابات في الكروموسومات الجنسية تؤثر على النمو والخصوبة.
الأمراض متعددة العوامل تنتج عن تفاعل جينات متعددة مع عوامل بيئية. أمراض القلب والسكري من النوع الثاني وبعض أنواع السرطان تندرج تحت هذه الفئة. هذه الأمراض لا تتبع نمطاً وراثياً واضحاً، لكن وجود تاريخ عائلي للمرض يزيد من احتمالية الإصابة. الوراثة الميتوكوندريا نوع خاص من الوراثة يحدث عبر DNA الموجود في الميتوكوندريا، وينتقل حصرياً من الأم لأن البويضة تساهم بكل الميتوكوندريا في الجنين بينما الحيوان المنوي يساهم بالحمض النووي فقط.
التشخيص المبكر للأمراض الوراثية أصبح ممكناً بفضل التقدم في تقنيات الفحص الجيني. الفحوصات قبل الولادة مثل بزل السلى وفحص الزغابات المشيمية تسمح باكتشاف اضطرابات كروموسومية وجينية معينة قبل ولادة الطفل. الفحص الجيني للأطفال حديثي الولادة روتين قياسي في العديد من الدول لاكتشاف أمراض مثل الفينيل كيتونيوريا، حيث يمكن للتدخل المبكر منع حدوث مضاعفات خطيرة.
علاج الأمراض الوراثية يتراوح من العلاجات التلطيفية التي تخفف الأعراض إلى العلاجات المتقدمة مثل العلاج الجيني. العلاج الجيني يهدف إلى إصلاح أو استبدال الجينات المعيبة، وقد شهد تقدماً ملحوظاً في السنوات الأخيرة. فهم الجهاز المناعي وكيفية تفاعله مع العلاجات الجينية أمر بالغ الأهمية لنجاح هذه التقنيات الثورية.
| المرض الوراثي | نمط الوراثة | الجين/الكروموسوم المتأثر | الأعراض الرئيسية | خيارات العلاج المتاحة |
|---|---|---|---|---|
| فقر الدم المنجلي | متنحٍّ جسدي | جين HBB (الهيموغلوبين) | فقر دم مزمن، نوبات ألم حادة، تلف الأعضاء | نقل الدم، زرع نخاع العظم، علاج جيني تجريبي |
| التليف الكيسي | متنحٍّ جسدي | جين CFTR | إفرازات مخاطية كثيفة، مشاكل تنفسية وهضمية | علاج الأعراض، أدوية CFTR، علاج جيني |
| متلازمة داون | كروموسومي | تثلث الكروموسوم 21 | إعاقة ذهنية، سمات وجهية مميزة، مشاكل قلبية | دعم تعليمي وتأهيلي، متابعة طبية |
| الهيموفيليا | متنحٍّ مرتبط بـ X | جينات عوامل التخثر (VIII أو IX) | نزيف مفرط، نزيف داخلي في المفاصل | عوامل تخثر بديلة، علاج جيني حديث |
| مرض هنتنغتون | سائد جسدي | جين HTT | اضطرابات حركية، تدهور إدراكي، تغيرات نفسية | علاج داعم للأعراض (لا يوجد شفاء) |
| الثلاسيميا | متنحٍّ جسدي | جينات سلاسل الغلوبين | فقر دم، تضخم الطحال، مشاكل في النمو | نقل الدم المنتظم، زرع نخاع العظم |
التطبيقات الحديثة لعلم الوراثة
التطبيقات الطبية
أحدث علم الوراثة ثورة في الطب الحديث، وتتعدد تطبيقاته في المجال الطبي بشكل يومي:
- الطب الشخصي: استخدام المعلومات الجينية لتخصيص العلاجات للمرضى بناءً على تركيبهم الوراثي الفريد، مما يزيد من فعالية العلاج ويقلل من الآثار الجانبية.
- اختبارات الأبوة والنسب: تحديد العلاقات البيولوجية بين الأفراد بدقة عالية جداً تصل إلى 99.9% باستخدام تحليل بصمة DNA الفريدة لكل شخص.
- الطب الجنائي: استخدام تحليل DNA في التحقيقات الجنائية لتحديد هوية المشتبه بهم أو الضحايا، وهي تقنية أصبحت أداة لا غنى عنها في العدالة الجنائية الحديثة.
- التشخيص المبكر للأمراض: فحص الأفراد الأصحاء لتحديد استعدادهم الوراثي للإصابة بأمراض معينة، مما يسمح باتخاذ تدابير وقائية مبكرة.
- تطوير الأدوية: استخدام المعلومات الجينية لتصميم أدوية جديدة تستهدف آليات جزيئية محددة، مما يسرع عملية تطوير العلاجات الفعالة.
التطبيقات الزراعية
في مجال الزراعة، أسهمت الوراثة في تحسين المحاصيل بطرق لم تكن ممكنة من قبل. تربية النباتات المحسنة وراثياً أنتجت أصنافاً أكثر مقاومة للآفات والأمراض، وأكثر تحملاً للظروف البيئية القاسية مثل الجفاف والملوحة. هذه التطورات حيوية لتحقيق الأمن الغذائي في ظل تزايد عدد السكان العالمي وتغير المناخ.
المحاصيل المعدلة وراثياً مثل الذرة والقطن وفول الصويا المقاومة للحشرات أو مبيدات الأعشاب تُزرع على نطاق واسع في العديد من البلدان. تقنيات مثل تحرير الجينات باستخدام CRISPR تفتح آفاقاً جديدة لتحسين الخصائص الغذائية للمحاصيل، مثل الأرز الذهبي المدعم بفيتامين A. تطبيقات الوراثة في الحيوانات الزراعية تشمل تحسين إنتاج اللحوم والحليب، وزيادة مقاومة الحيوانات للأمراض.
التطبيقات البيئية والحفاظ على التنوع البيولوجي
علم الوراثة يلعب دوراً متزايد الأهمية في جهود الحفاظ على الأنواع المهددة بالانقراض. تحليل التنوع الوراثي في المجموعات الصغيرة يساعد في تصميم برامج تربية فعالة تحافظ على الصحة الوراثية للأنواع. التقنيات الوراثية تستخدم أيضاً في استعادة الأنواع المنقرضة أو شبه المنقرضة، وفي مكافحة الآفات الغازية بطرق صديقة للبيئة.
البصمة الوراثية للمجموعات السكانية تساعد في فهم أنماط الهجرة والتدفق الجيني بين المجموعات المختلفة. هذه المعلومات ضرورية لإدارة الموارد الطبيعية بشكل مستدام. المصادر العلمية المتخصصة تشير إلى أن الوراثة الحفظية أصبحت أداة أساسية في مواجهة أزمة التنوع البيولوجي العالمية.
اقرأ أيضاً: علم وظائف الأعضاء (Physiology): استكشاف آليات الحياة
الهندسة الوراثية وتعديل الصفات
الهندسة الوراثية (Genetic Engineering) هي التعديل المباشر والمتعمد لجينوم الكائن الحي باستخدام تقنيات التكنولوجيا الحيوية. تتضمن هذه العملية إدخال، حذف، أو تعديل الجينات لإنتاج خصائص مرغوبة أو القضاء على خصائص غير مرغوبة. بدأت الهندسة الوراثية في السبعينيات مع تطوير تقنيات الحمض النووي المأشوب (Recombinant DNA)، حيث تمكن العلماء من قطع ولصق قطع من DNA من كائنات مختلفة.
إحدى التطبيقات المبكرة والناجحة للهندسة الوراثية كانت إنتاج الإنسولين البشري باستخدام بكتيريا معدلة وراثياً. قبل ذلك، كان مرضى السكري يعتمدون على الإنسولين المستخرج من البنكرياس الحيواني، والذي كان مكلفاً وقد يسبب ردود فعل تحسسية. اليوم، معظم الإنسولين المستخدم طبياً يُنتج بواسطة كائنات دقيقة معدلة وراثياً، مما يوفر إمداداً آمناً ووفيراً ومنخفض التكلفة.
تقنية CRISPR-Cas9 تمثل قفزة نوعية في مجال تحرير الجينات، حيث تسمح بتعديل دقيق وسهل نسبياً للجينوم. هذه التقنية مستوحاة من نظام دفاعي طبيعي في البكتيريا ضد الفيروسات، وتتيح للعلماء استهداف جينات محددة بدقة عالية. التطبيقات المحتملة لـ CRISPR واسعة، من علاج الأمراض الوراثية إلى تحسين المحاصيل الزراعية، وحتى القضاء على الأمراض المعدية عن طريق تعديل الكائنات الناقلة للأمراض.
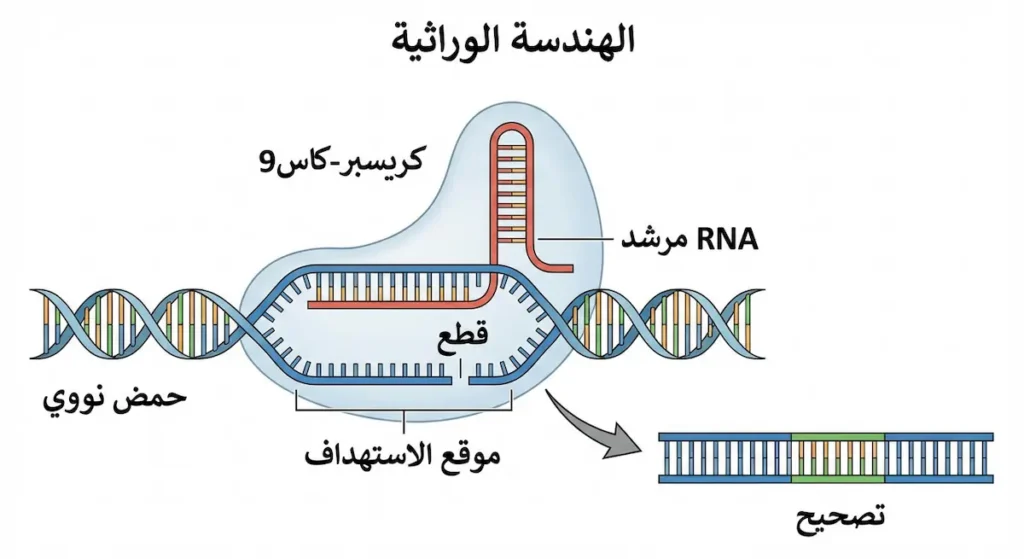
لكن الهندسة الوراثية تثير أيضاً قضايا أخلاقية واجتماعية معقدة. التعديل الوراثي للأجنة البشرية موضوع جدل واسع، حيث يخشى البعض من إنشاء “أطفال مصممين” أو تفاقم عدم المساواة الاجتماعية. السلامة طويلة المدى للأغذية المعدلة وراثياً والكائنات المعدلة وراثياً في البيئة تتطلب دراسات مستمرة. يعمل الباحثون في المجالات العلمية على وضع أطر تنظيمية وأخلاقية لضمان استخدام هذه التقنيات القوية بطريقة مسؤولة ومفيدة للبشرية.
الناقلات الوراثية (Vectors) هي أدوات أساسية في الهندسة الوراثية، وأكثرها شيوعاً البلازميدات والفيروسات المعدلة. البلازميدات هي جزيئات DNA دائرية صغيرة توجد بشكل طبيعي في البكتيريا، ويمكن تعديلها لحمل الجينات المرغوبة وإدخالها إلى خلايا أخرى. الفيروسات المعدلة تستخدم قدرتها الطبيعية على إدخال المادة الوراثية إلى الخلايا، لكن بعد إزالة الجينات الضارة واستبدالها بجينات علاجية.
معلومة سريعة:
تقنية CRISPR التي أحدثت ثورة في تعديل الجينات حصلت على جائزة نوبل في الكيمياء عام 2020. اسمها اختصار لـ “التكرارات العنقودية المتناظرة القصيرة منتظمة التباعد”، وهي مستوحاة من نظام مناعي طبيعي تستخدمه البكتيريا للدفاع ضد الفيروسات!
الاستشارة الوراثية
الاستشارة الوراثية (Genetic Counseling) خدمة طبية متخصصة تساعد الأفراد والعائلات على فهم المخاطر الوراثية والخيارات المتاحة لهم. المستشارون الوراثيون محترفون مدربون على تفسير التاريخ الطبي والعائلي، وشرح كيفية انتقال الحالات الوراثية، وتقديم معلومات حول الفحوصات الجينية المتاحة وتفسير نتائجها. هذه الخدمة ضرورية للأزواج الذين لديهم تاريخ عائلي لأمراض وراثية، أو النساء الحوامل الأكبر سناً، أو الذين أنجبوا طفلاً مصاباً بحالة وراثية.
عملية الاستشارة الوراثية تبدأ عادة بجمع معلومات مفصلة عن التاريخ الطبي والعائلي لعدة أجيال، ما يسمى بشجرة العائلة أو النسب (Pedigree). تحليل هذه المعلومات يساعد في تحديد أنماط الوراثة وتقدير احتمالات انتقال الحالة الوراثية إلى الأبناء. بناءً على هذا التقييم، قد يوصي المستشار بإجراء فحوصات جينية محددة للتأكد من التشخيص أو تحديد حالة الحمل للجين المعيب.
نتائج الفحوصات الجينية قد تكون معقدة وتحتاج إلى تفسير دقيق. المستشار الوراثي يشرح معنى النتائج الإيجابية والسلبية وغير الحاسمة، ويناقش الآثار الطبية والنفسية والاجتماعية لهذه النتائج. كما يساعد الأفراد في اتخاذ قرارات مستنيرة بشأن خيارات الإنجاب، أو المراقبة الطبية، أو التدخلات الوقائية. الدعم النفسي جزء مهم من الاستشارة الوراثية، حيث أن التعامل مع المعلومات الوراثية قد يكون مرهقاً عاطفياً للأفراد والعائلات.

تشمل فوائد الاستشارة الوراثية اتخاذ قرارات إنجابية مدروسة، والتشخيص المبكر والعلاج للحالات القابلة للعلاج، وتخفيف القلق من خلال المعلومات الدقيقة. البيولوجيا الحديثة والتقدم في علم الوراثة جعلا الاستشارة الوراثية أكثر دقة وشمولاً من أي وقت مضى. مع تطور تقنيات الفحص الجيني وانخفاض تكلفتها، أصبحت الاستشارة الوراثية متاحة لشريحة أوسع من الناس، مما يسهم في تحسين الصحة العامة والوقاية من الأمراض الوراثية.
الجوانب الأخلاقية والقانونية للفحوصات الوراثية معقدة وتتطلب اهتماماً خاصاً. قضايا مثل الخصوصية الوراثية، والتمييز المحتمل في التوظيف أو التأمين بناءً على المعلومات الوراثية، والموافقة المستنيرة، كلها تحتاج إلى ضمانات قانونية وأخلاقية. العديد من الدول سنت قوانين لحماية الأفراد من التمييز الوراثي، لكن التحديات مستمرة مع تطور التقنيات الجينية بسرعة تفوق القدرة التنظيمية في بعض الأحيان.
مستقبل الوراثة البشرية وعلم الجينات
مستقبل الوراثة يحمل إمكانيات هائلة قد تغير وجه الطب والزراعة والمجتمع بشكل جذري. مشروع الجينوم البشري، الذي اكتمل في 2003، كان مجرد البداية، حيث فتح الباب أمام فهم أعمق للتنوع الوراثي البشري والأساس الجيني للأمراض. اليوم، أصبح تسلسل الجينوم الشخصي متاحاً بتكلفة معقولة، ومن المتوقع أن يصبح جزءاً روتينياً من الرعاية الطبية في المستقبل القريب.
الطب الدقيق أو الطب الشخصي يمثل تحولاً كبيراً في كيفية فهمنا للأمراض وعلاجها. بدلاً من اتباع نهج “مقاس واحد يناسب الجميع”، يهدف الطب الدقيق إلى تخصيص الوقاية والعلاج بناءً على التركيب الوراثي الفريد لكل فرد، وعوامل نمط الحياة والبيئة. هذا النهج يعد بعلاجات أكثر فعالية وأقل آثاراً جانبية، خاصة في مجالات مثل السرطان حيث التباين الوراثي بين الأورام كبير.
العلاج الجيني يتقدم بخطى سريعة، مع موافقات تنظيمية حديثة لعلاجات جينية لأمراض كانت تعتبر غير قابلة للعلاج. علاج الخلايا بالجينات CAR-T لبعض أنواع سرطان الدم يمثل مثالاً ناجحاً على استخدام الهندسة الوراثية لتعزيز قدرات المناعة الذاتية للجسم على محاربة المرض. تقنيات تحرير القاعدة (Base Editing) والتحرير الأولي (Prime Editing) تمثل الجيل التالي من أدوات تحرير الجينات، بدقة أعلى وآثار جانبية أقل من CRISPR التقليدي.
الذكاء الاصطناعي والتعلم الآلي يحدثان ثورة في تحليل البيانات الجينية الضخمة. القدرة على تحليل ملايين التسلسلات الجينية وربطها بالسمات الفينوتيبية والأمراض تفتح آفاقاً جديدة لاكتشاف علاقات جينية كانت مخفية سابقاً. هذه التقنيات تسرع أيضاً عملية اكتشاف الأدوية وتساعد في التنبؤ بفعالية العلاجات لمرضى معينين.
الأخلاقيات الحيوية ستصبح أكثر أهمية مع تقدم قدراتنا على التلاعب بالجينوم. أسئلة مثل: إلى أي مدى يجب أن نذهب في تعديل الجينوم البشري؟ وكيف نضمن الوصول العادل للتقنيات الوراثية المتقدمة؟ ومن يملك المعلومات الوراثية الشخصية ويتحكم بها؟ كلها قضايا تحتاج إلى حوار مجتمعي واسع وتنظيم دقيق. المعلومات والأبحاث المستمرة ضرورية لإبقاء الجمهور والمشرعين على اطلاع بالتطورات السريعة في هذا المجال.
التطبيقات البيئية للوراثة قد تساعد في مواجهة تحديات عالمية مثل تغير المناخ والأمن الغذائي. تطوير محاصيل قادرة على النمو في ظروف مناخية متطرفة، أو كائنات دقيقة قادرة على تحلل الملوثات البلاستيكية، أو طحالب محسنة لإنتاج الوقود الحيوي، كلها احتمالات واقعية في المستقبل القريب. الوراثة التركيبية (Synthetic Biology)، التي تهدف إلى تصميم وبناء أنظمة بيولوجية جديدة، قد تؤدي إلى ابتكارات غير متوقعة في مجالات متنوعة من الطاقة إلى المواد الحيوية.
إن فهم الوراثة واستخداماتها المتقدمة يتطلب تعليماً علمياً أفضل للجمهور العام. محو الأمية الجينية ضروري لتمكين الأفراد من اتخاذ قرارات مستنيرة بشأن صحتهم وحياتهم. الموسوعات العلمية والمصادر التعليمية الموثوقة تلعب دوراً حيوياً في نشر المعرفة حول الوراثة وتطبيقاتها وآثارها الأخلاقية والاجتماعية. مع استمرار تقدم علم الوراثة بسرعة مذهلة، فإن البقاء على اطلاع وفهم للتطورات الجديدة أصبح أكثر أهمية من أي وقت مضى.
في الختام، تمثل الوراثة أحد أعمق وأكثر المجالات العلمية تأثيراً في حياتنا المعاصرة. من فهم كيفية انتقال الصفات عبر الأجيال إلى تطوير علاجات ثورية للأمراض، ومن تحسين الأمن الغذائي إلى الحفاظ على التنوع البيولوجي، فإن تطبيقات علم الوراثة لا حدود لها تقريباً. مع كل اكتشاف جديد في مجال الوراثة، نكتسب فهماً أعمق لأنفسنا وللعالم الطبيعي من حولنا، ونفتح أبواباً جديدة لإمكانيات كانت تبدو مستحيلة بالأمس. لكن مع هذه القوة العظيمة تأتي مسؤولية كبيرة، حيث يجب علينا استخدام معرفتنا الوراثية بحكمة وأخلاقية لضمان مستقبل أفضل للبشرية جمعاء.
في حياتك اليومية:
كل يوم، تحدث في جسمك ما بين 10,000 إلى 100,000 طفرة جينية! لكن لا داعي للقلق؛ فخلاياك تمتلك “فريق صيانة” متخصصاً من الإنزيمات يعمل على مدار الساعة لاكتشاف هذه الأخطاء وإصلاحها قبل أن تُسبب أي ضرر.
الأسئلة الشائعة حول الوراثة
1. ما هو الفرق بين الجين والكروموسوم؟
الجين هو الوحدة الأساسية للوراثة وهو عبارة عن قطعة محددة من الحمض النووي تحمل معلومات لإنتاج بروتين معين أو أداء وظيفة بيولوجية محددة. أما الكروموسوم فهو تركيب خيطي أكبر بكثير يتكون من جزيء DNA طويل ملفوف حول بروتينات، ويحتوي الكروموسوم الواحد على مئات إلى آلاف الجينات. يمكن تشبيه العلاقة بينهما بالكتاب والفصول، حيث يمثل الكروموسوم الكتاب الكامل بينما تمثل الجينات الفصول المختلفة داخله. في الإنسان، يوجد 46 كروموسوماً في كل خلية جسدية، تحتوي مجتمعة على حوالي 20,000 إلى 25,000 جين.
2. لماذا يختلف الأطفال عن والديهم رغم حصولهم على جينات منهما؟
يحصل كل طفل على نصف جيناته من الأم والنصف الآخر من الأب، لكن العملية ليست مجرد نسخ مباشر. خلال تكوين الخلايا الجنسية، تحدث عملية تسمى العبور الجيني أو إعادة التركيب، حيث تتبادل الكروموسومات المتماثلة أجزاء من DNA، مما ينتج تركيبات جينية فريدة. بالإضافة إلى ذلك، هناك احتمالات متعددة لأي من الأليلات سيحصل عليها الطفل من كل والد، مما يخلق تنوعاً هائلاً. كما أن بعض الصفات تتأثر بعوامل بيئية وتفاعلات معقدة بين جينات متعددة، مما يزيد من التنوع الظاهري بين الأشقاء حتى من نفس الوالدين.
3. هل يمكن تغيير الجينات التي ورثناها من آبائنا؟
الجينات التي نرثها من الوالدين ثابتة في معظم خلايا جسمنا ولا يمكن تغييرها بشكل طبيعي. ومع ذلك، التقدم العلمي الحديث وفر تقنيات مثل العلاج الجيني وتحرير الجينات باستخدام CRISPR التي تسمح بتعديل الجينات في الخلايا المستهدفة لعلاج الأمراض. هذه التعديلات في الخلايا الجسدية لا تنتقل إلى الأجيال التالية. أما تعديل الجينات في الخلايا الجنسية أو الأجنة فهو موضوع جدل أخلاقي كبير ومحظور في معظم الدول. من المهم التمييز بين تغيير الجينات نفسها وبين تغيير التعبير الجيني، حيث أن عوامل مثل النظام الغذائي والبيئة يمكن أن تؤثر على كيفية تعبير الجينات دون تغيير تسلسل DNA الأساسي.
4. ما هي الطفرات الجينية وهل كلها ضارة؟
الطفرات الجينية هي تغييرات دائمة في تسلسل الحمض النووي، وتحدث بشكل طبيعي أثناء تضاعف DNA أو نتيجة للتعرض لعوامل بيئية مطفرة. ليست كل الطفرات ضارة، بل يمكن تصنيفها إلى ثلاث فئات رئيسة: طفرات مفيدة تحسن القدرة على البقاء أو التكاثر، طفرات محايدة لا تؤثر على الوظيفة البيولوجية، وطفرات ضارة تعيق الوظائف الطبيعية أو تسبب أمراضاً. في الواقع، معظم الطفرات محايدة أو ضارة بدرجة طفيفة جداً بحيث لا تؤثر بشكل ملحوظ. الطفرات المفيدة نادرة لكنها مهمة جداً لأنها مصدر التنوع الوراثي الذي يسمح للكائنات الحية بالتكيف مع البيئات المتغيرة.
5. كيف تنتقل الأمراض الوراثية من جيل إلى آخر؟
تنتقل الأمراض الوراثية وفقاً لأنماط محددة تعتمد على موقع الجين المعيب ونوع الأليل المسبب للمرض. في الأمراض الجسدية المتنحية، يجب أن يحمل الشخص نسختين من الأليل المعيب لإظهار المرض، بينما يكون الأشخاص الذين يحملون نسخة واحدة حاملين صحيين. في الأمراض الجسدية السائدة، نسخة واحدة من الأليل المعيب كافية لإظهار المرض. الأمراض المرتبطة بالجنس تتبع نمطاً مختلفاً لأنها مرتبطة بالكروموسومات الجنسية، وعادة ما تصيب الذكور أكثر من الإناث في حالة الجينات المتنحية المرتبطة بكروموسوم X. فهم هذه الأنماط ضروري للاستشارة الوراثية والتخطيط الأسري المستنير.
6. ما الفرق بين النمط الجيني والنمط الظاهري؟
النمط الجيني يشير إلى التركيب الوراثي الفعلي للفرد، أي مجموعة الجينات والأليلات التي يحملها في DNA الخاص به. هذه المعلومات مخفية ولا يمكن رؤيتها بالعين المجردة، بل تحتاج إلى فحوصات جزيئية لتحديدها. في المقابل، النمط الظاهري هو التعبير المرئي أو القابل للقياس لهذه الجينات، مثل لون العيون، الطول، أو فصيلة الدم. العلاقة بين النمط الجيني والنمط الظاهري ليست دائماً مباشرة، فالنمط الظاهري يتأثر بالنمط الجيني بالإضافة إلى العوامل البيئية والتفاعلات المعقدة بين الجينات المختلفة. قد يكون لأفراد مختلفين في النمط الجيني نفس النمط الظاهري، والعكس صحيح في بعض الحالات.
7. هل التوائم المتطابقة لها نفس الجينات تماماً؟
التوائم المتطابقة أو أحادية الزيجوت تنشأ من انقسام بويضة مخصبة واحدة، لذلك تبدأ حياتها بنفس المادة الوراثية تماماً. ومع ذلك، مع مرور الوقت قد تحدث اختلافات جينية طفيفة بينهما نتيجة للطفرات الجسدية التي تحدث بعد الانقسام أو أثناء نمو الأفراد. بالإضافة إلى ذلك، التعديلات الإبيجينية، وهي تغييرات في كيفية التعبير عن الجينات دون تغيير تسلسل DNA نفسه، يمكن أن تختلف بين التوائم المتطابقة نتيجة لخبرات حياتية وبيئية مختلفة. هذا يفسر لماذا قد تختلف التوائم المتطابقة في بعض الصفات أو القابلية للإصابة بأمراض معينة، رغم تشابههما الوراثي الكبير.
8. ما هو العلاج الجيني وكيف يعمل؟
العلاج الجيني هو أسلوب طبي مبتكر يهدف إلى علاج الأمراض أو الوقاية منها عن طريق إدخال، تعديل، أو استبدال الجينات المعيبة في خلايا المريض. تعتمد الفكرة الأساسية على تصحيح السبب الجذري للمرض على المستوى الجيني بدلاً من مجرد علاج الأعراض. يتم إدخال الجين السليم عادة باستخدام ناقل فيروسي معدل بحيث لا يسبب مرضاً، أو بطرق فيزيائية أو كيميائية أخرى. هناك نوعان رئيسيان من العلاج الجيني: العلاج الجيني الجسدي الذي يستهدف خلايا غير جنسية ولا تنتقل التغييرات للأجيال التالية، والعلاج الجيني للخط الجنسي الذي يعدل الخلايا الجنسية أو الأجنة المبكرة وهو محل جدل أخلاقي كبير. رغم الوعود الكبيرة، لا يزال العلاج الجيني يواجه تحديات تقنية وأخلاقية.
9. لماذا تختلف فصائل الدم بين الناس؟
فصائل الدم تحددها الجينات التي تتحكم في وجود مستضدات معينة على سطح خلايا الدم الحمراء. نظام ABO، وهو الأكثر شهرة، يتحكم فيه جين واحد له ثلاثة أليلات: A وB وO. الأليلان A وB سائدان بالتساوي، بينما O متنحي. هذا يعني أن الشخص يمكن أن يكون لديه فصيلة دم A أو B أو AB أو O اعتماداً على الأليلات التي ورثها من والديه. عامل Rh هو نظام آخر يحدد ما إذا كانت فصيلة الدم موجبة أو سالبة. التنوع في فصائل الدم بين المجموعات السكانية ينتج عن التوزيع المختلف لهذه الأليلات في المجموعات الوراثية المختلفة. فهم فصائل الدم ضروري لنقل الدم الآمن وإدارة الحمل عندما تختلف فصائل دم الأم والجنين.
10. هل يمكن للبيئة أن تؤثر على الجينات؟
البيئة لا تغير تسلسل DNA الأساسي للجينات، لكنها تؤثر بشكل كبير على كيفية التعبير عن هذه الجينات، وهو مجال يسمى الإبيجينيتيكس. العوامل البيئية مثل النظام الغذائي، التوتر، التدخين، والتعرض للسموم يمكن أن تضيف أو تزيل علامات كيميائية على DNA أو البروتينات المرتبطة به، مما يؤثر على تشغيل أو إيقاف جينات معينة. هذه التعديلات الإبيجينية يمكن أن تؤثر على الصحة والقابلية للإصابة بالأمراض، وبشكل مثير للاهتمام، بعضها يمكن أن ينتقل إلى الأجيال التالية. هذا يوضح أن الوراثة ليست حتمية تماماً، بل هي تفاعل معقد بين الاستعداد الوراثي والعوامل البيئية. فهم هذا التفاعل مهم لتطوير إستراتيجيات وقائية وعلاجية أكثر فعالية.
قسم المراجع والمصداقية
المراجع
الكتب الأكاديمية
Griffiths, A. J. F., Wessler, S. R., Carroll, S. B., & Doebley, J. (2015). Introduction to genetic analysis (11th ed.). W. H. Freeman and Company.
— يُعد هذا الكتاب المرجع الأساسي في تدريس علم الوراثة بالجامعات عالمياً، ويُغطي المفاهيم الأساسية من قوانين مندل إلى الوراثة الجزيئية الحديثة.
Hartl, D. L., & Ruvolo, M. (2012). Genetics: Analysis of genes and genomes (8th ed.). Jones & Bartlett Learning. ISBN: 978-1449635961
— مرجع شامل يربط بين الوراثة الكلاسيكية والجينوميات الحديثة، ويدعم أقسام المقال المتعلقة بالجينات والكروموسومات وأنماط الوراثة.
الأوراق البحثية والتقارير المُحكَّمة
Lander, E. S., Linton, L. M., Birren, B., Nusbaum, C., Zody, M. C., Baldwin, J., … & International Human Genome Sequencing Consortium. (2001). Initial sequencing and analysis of the human genome. Nature, 409(6822), 860-921. https://doi.org/10.1038/35057062
— الورقة التاريخية التي أعلنت اكتمال مشروع الجينوم البشري، وتدعم قسم الحمض النووي والتطبيقات الحديثة لعلم الوراثة.
Jinek, M., Chylinski, K., Fonfara, I., Hauer, M., Doudna, J. A., & Charpentier, E. (2012). A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science, 337(6096), 816-821. https://doi.org/10.1126/science.1225829
— الورقة التأسيسية لتقنية CRISPR-Cas9 التي أحدثت ثورة في تحرير الجينات، وتدعم قسم الهندسة الوراثية ومستقبل علم الوراثة.
Visscher, P. M., Wray, N. R., Zhang, Q., Sklar, P., McCarthy, M. I., Brown, M. A., & Yang, J. (2017). 10 years of GWAS discovery: Biology, function, and translation. The American Journal of Human Genetics, 101(1), 5-22. https://doi.org/10.1016/j.ajhg.2017.06.005
— مراجعة علمية شاملة لعقد من اكتشافات دراسات الارتباط على مستوى الجينوم، تدعم أقسام الوراثة متعددة الجينات والأمراض الوراثية.
الدراسات التطبيقية وفصول الكتب
Nussbaum, R. L., McInnes, R. R., & Willard, H. F. (2016). Thompson & Thompson genetics in medicine (8th ed.). Elsevier. ISBN: 978-1437706963
— المرجع الطبي الأساسي في الوراثة السريرية، يدعم أقسام الأمراض الوراثية والاستشارة الوراثية والتطبيقات الطبية بأمثلة تطبيقية من الممارسة السريرية.
قسم المصداقية
المصادر التي تمت مراجعتها
اعتمد هذا المقال على مصادر أكاديمية مُحكَّمة تشمل:
- كتب جامعية معتمدة من ناشرين أكاديميين مرموقين (W. H. Freeman، Elsevier، Jones & Bartlett)
- أوراق بحثية منشورة في مجلات علمية رائدة (Nature، Science، The American Journal of Human Genetics)
- مراجع طبية سريرية مستخدمة في كليات الطب عالمياً
تم التحقق من جميع المراجع المذكورة عبر قواعد البيانات العلمية المعتمدة (PubMed، Google Scholar).
إخلاء المسؤولية
تنويه هام: المعلومات الواردة في هذا المقال ذات طبيعة تثقيفية وتعليمية عامة، ولا تُغني عن استشارة الطبيب المختص أو المستشار الوراثي المعتمد. القرارات الطبية المتعلقة بالفحوصات الجينية أو التشخيص أو العلاج يجب أن تُتخذ بالتشاور مع مقدمي الرعاية الصحية المؤهلين. علم الوراثة مجال سريع التطور، وقد تتغير بعض المعلومات مع ظهور اكتشافات جديدة.
جرت مراجعة هذا المقال من قبل فريق التحرير في موقعنا لضمان الدقة والمعلومة الصحيحة.